EBM 実践における4つの輪(Evidence based practice における患者と医師の選択 BMJ 2002:Free)
Physicians' and patients' choices in evidence based practice.
Haynes RB, et al. BMJ. 2002.
PMID:12052789

"Evidence does not make decisions, people do"
Figure.1 本文より引用
⌘ 結論
"エビデンスは意思決定をしない、(意思決定は)人々が行うのだ" というコトバと Figure.1 が全てである。Figure.1 より、エビデンスは 4 つの輪の内の一つであり意思決定には関わるが大部分を占めているわけではないことが分かる。
⌘ 以下、本文
Evidence based medicine (EBM) に向けられた批判、それは臨床家の手(自由)を拘束し、患者による最適ケア決定に至るための選択肢を奪う点にある。
実際に保険・衛生研究を実施するには多くの障壁がある。しかし概念的には臨床家の手を縛り、患者の選択(権)を奪うことは無い。むしろ患者の嗜好は、EBM の初期モデルに組み込まれており、その重要性は 2000 年頃に改訂された Figure. 1 で強調されている。
この図における臨床的判断では;
第 1 に、何が間違っていて、どのような治療オプションが利用可能であるかを確立するために、患者の臨床的および身体的状況を考慮(把握)する必要がある。
第 2 に、治療オプションは選択肢の有効性、実効性、効率性に関する臨床エビエンスによって調整される必要がある。
第 3 に、臨床医は各オプションに関連するであろう患者の嗜好性および可能性のある行動(彼あるいは彼女がどのような介入を受け入れる準備ができているかという点で)を考慮しなければならない。
最後に、これらの考察をまとめ、患者が受け入れやすい治療法を勧めるには臨床的専門知識が必要である。
いずれの状況においても、患者の臨床状態および状況が優先される可能性がある。例えば、僻地滞在間に胸の痛みを覚える人は、アセチルサリチル酸が唯一の有効な治療薬であれば、これを飲まざるを得ないかもしれないが、より大きなコミュニティ(都会?)では、より多くの治療法がある(一硝酸イソソルビドやニトログリセリン舌下、テープ剤等)。その他の例としては、過去に命にかかわる出血を経験した人のうち、輸血に対し批判的な宗教的信念を持っている人は、代替手段(医療)しか受け入れない可能性が高い。
対照的に、エビデンスのみでは意思決定を行えない。したがって、心房細動患者の抗凝固療法におけるエビデンスに基づく決定は、(過去の臨床試験によって)実証された抗凝固効果とその潜在的有害作用によって決定されるだけでなく、個々の臨床状況(例えば、患者の年齢や出血歴)および患者の好みが含まれる。例えば最近の研究では、脳卒中リスク低下の代償として許容され得る出血リスクが、患者毎で大きく異なることが示唆されている。さらに同研究において、ワーファリンまたはアスピリンによる(脳卒中予防に伴う)有害事象の出血に対して、一般的に患者は医療者よりも嫌悪感を示さないことが報告されている。
状況によって、患者によって(意思)決定は異なる可能性があるという概念は、ますます注目されている。しかし意思決定に影響を及ぼすファクターについて、正しいバランスを取ることは必ずしも容易では無い。実際、患者にエビデンスを提供することで、患者が情報選択することは挑戦的であり、多くの場合、医師-患者間のコミュニケーションにおける現状認識を超えている。最大の課題は新たなエビデンス生成を待つことである。
EBM という用語は、臨床家と患者が意思決定を下す際に現在の最善のエビデンスにとどまることなく、敬意を払うことへの奨励のために開発された。代替用語としては、(より魅力的なものがあるかもしれないが)臨床研究で強化したヘルスケアです。どちらの用語が適用されても、特に患者の希望が考慮されている場合は、臨床での実践においてエビデンスのより良い利用に自信を持つことができる。
⌘ 感想
個々の医療従事者が認識している、あるいは耳にしたことのある臨床試験の結果は極々一部であり、また目の前の患者に完全に当てはまる背景となると皆無に近い。
個々の医療従事者が論文を読むことに加え、患者の嗜好を考慮し、患者の置かれた環境、過去の臨床試験を用い総合的に判断することで、現状もっとも良いであろうと考えられる治療内容の提案、実施が可能ではなかろうか。そこには患者の理解度も重要であり、患者個々に合わせた平易な言葉が求められる。もちろんコンコーダンスという概念に従うのも良いと思う。
新薬ありきではない医療、コストベネフィットやコストパフォーマンスが日本でも注目され、昨年には HTA も導入されました。ここを好機と捉え行動するか現状維持のまま行くのかは個々の判断によります。ただ少なくとも、巷に出回ってるガイドラインの中には不適切なものもあることを知って欲しいし、妄信するのではなく『あくまで推奨』であると捉えて欲しい。
情報は日々アップデートされ、今読んでいる本、ガイドライン、論文は、すでに過去のものであるという研究結果もあるので、こちらについてもブログにアップしていきたいと思います。
私としては、エビデンスは心の拠り所であるとする考えが今のところ一番しっくりくる。
Evidence-based medicine (EBM) の必要性(Therapie 1996:Abstract only):Dear Dr. Sackett ①
PMID:8881108
EBM の父、Sackett 先生の文献を読んでいこうと思い立ったので、気になった文献を読んでみたシリーズ①。
医師は常に最良のエビデンスに基づいて(診断や治療方針の)決定を下そうとする。このエビデンスは患者由来のデータに基づいて確立された事実ではなく、しばしば病態生理学的原理および論理の外挿を表す。無作為化比較試験の出現および増殖は、臨床歴および診察、診断、予後、治療、そして他の重要な医療問題に関する臨床的に有効なエビデンスの量および質の急速な増加をもたらした。その結果、臨床専門家の暗黙の非言語的推論の多くを明示することが可能になり、臨床的推論をより理解しやすくなっただけでなく、研修者が(情報に)アクセスしやすくなる。
エビデンスを追跡し、批判的に評価し、臨床実践に組み込む能力は「Evidence-based medicine」と名付けられている。有効なエビデンスの量が増えるにつれて、我々一人ひとりがそのエビデンスを同化し、評価し、そのエビデンスを最大限に活用するために必要なスキルを開発する必要性が生じる。しばしば我々は、臨床的に重要な知識に対する日々のニーズを特定したり解決したりせず、(結果として)臨床能力の漸進的な低下を招くことがある。私たちが知識を求めるとき、学術誌や教科書などの伝統的な情報源は、しばしば混乱(誤っている、まとまりがない)しているか、(情報が)古いものであるため、我々はしばしば同僚に頼っている。
臨床的に重要な知識を維持し、拡大する必要性は、医学教育を継続することのニーズが高まっている昨今において、部分的に対処されているが、どのようにして成し遂げるのがベストだろうか?
近年の評価により、3つの EBM 戦略がこれらの目標を達成するのに役立つことが示唆されている。具体的には ① EBM の習得、② 他者が作成した EBM 要約の検索と適用、そして ③ 他者が開発した EBM の受け入れ、などが含まれます。
→ あら?今、継続しようとしていることと大差ないかも。医療従事者一人ひとりが EBM を実践しようと医学論文に触れ、各々の考察を加えまとめていき、情報を共有、実際に活用することで EBM という非日常が日常に近づいていくのかもしれない。より良い医療の実現するその日まで。
プラズマ乳酸菌(JCM5805株)は風邪やインフルエンザを予防できますか?
PMID:26234407
| UMIN 試験 ID: | UMIN000017274 |
⌘ 背景
Lactococcus lactis ssp.※ lactis JCM5805 は、マウスとヒト、両方の種において形質細胞様樹状細胞(plasmacytoid dendritic cells:pDC)を活性化するレアな乳酸菌である。pDC の活性化は NK 細胞や B 細胞、キラー T 細胞、インターフェロン(IFN)を活性化し、ウイルス感染予防に繋がるのではないかと期待されている。本研究では、冬季のインフルエンザ様病態への影響を評価するために、無作為化プラセボ対照二重盲検試験を実施した。
⌘ PICOT
P:健康な日本人 214 例(30-59 歳の男女・地域:東京、神奈川、千葉、埼玉)
組入基準:試験開始前の血液検査(WBC、RBC、Hb、Ht、MCV、MCH、MCHC、PLT、T-cho、TG、LDL-cho、HDL-cho、BUN、UN、Cre、UA、AST=GOT、ALT=GPT、γ-GT、γ-GTP、LD、LDH、CPK、CK、GLU)およびアンケート結果を基に 297 人から 214 例を選択
除外基準:免疫疾患患者、肝障害、腎障害、心臓病、貧血、不眠症、ミルクアレルギー、重度の花粉症、18 ヶ月以内にインフルエンザワクチン接種を受けている、日常的に乳酸菌あるいはヨーグルトを摂取している、妊娠中あるいは授乳中の女性、アルコール依存症、その他医師が不適であると判断した場合
I :JCM5805株のみを用いた乳酸菌飲料 100 mL/day、10 週間連続摂取
C:乳酸菌を含まないプラセボ飲料 100 mL/day、10 週間連続摂取
O:Primary → 風邪・インフルエンザ様症状の発症記録
Secondary → 摂取前(0週)、摂取後(10週)における血液免疫学的検査
T:ランダム化比較試験、予防効果、2013年1月〜3月のうち 10 週間
⌘ ランダム化されているか?
ランダム化されている
→ 年齢と性別を基にコンピューターにてランダム化
⌘ ランダム割付が隠蔽化されているか?(selection bias は無いか?)
中央割り付けであると判断した
⌘ マスキングされているか?(ブラインドか否か?)
されている double-blind
⌘ プライマリーアウトカムは真か?
予防という観点では真であると判断した
⌘ 交絡因子は網羅的に検討されているか?
(可能な範囲で)されていると判断した
⌘ Baseline は同等か?
同等(Table 1 より)
⌘ ITT 解析されているか?
本文から推測するに Full Analysis Set(FAS)であると考えられる
⌘ 追跡率(脱落)はどのくらいか?結果を覆す程か?
問題無し
◯プラセボ群:107/107 = 100.0%
◯介入群:106/107 = 99.1%
→ 被験者はクリニックを3回(試験組入時、ヨーグルト摂取開始前、摂取終了後)訪問する予定であったが、介入群のうち 1 名は訪問しなかった。
⌘ サンプルサイズは充分か?
試験結果から充分であると判断した(一応計算してるのかな)
→ 本文に「38 人の健常者で行ったパイロット試験の結果から、統計学的有意差 5% を得る為に必要なサンプルサイズを 80 と推計」しており、本試験では 100 例を設定している。
⌘ Setting
芝パレスクリニック(東京都)にて実施。1 つの施設のみ
→ インフルエンザの流行状況(東京都)の 2013年のデータから、流行ピーク期間をカバーできてはいるが、いかんせん 1 施設のみというのが気になるところ。
⌘ 結果は?
◯Primary outcome
風邪・インフルエンザ様症状の発症数:
→ プラセボ群 14 人 vs. 介入群 7 人(P = 0.127, χ2 test)
各症状:

(本文 Table 3 より引用)
→ 咳および発熱については有意差あり。特に介入群において Mild〜Severe の発生数は少ない。喉の痛みおよび頭痛については有意差無し。喉の痛みについては介入群において Severe は少ない傾向にあるが、頭痛の Severe は多い傾向であった。
◯Secondary outcome
血液免疫学的検査:
→ pDC の活性化マーカーである CD86 は、介入群で増加していたが、プラセボ群では変化が認められなかった。
→ インフルエンザ罹患後に増加するとされる IFN-α および IFN-stimulated gene(ISG)15 は、両群ともに増加していた。
◯副作用
→両群ともに副作用は報告されなかった(→ですよね〜)
⌘ 考察
今回用いられた(小岩井乳業株式会社製の)JCM5805 株の乳酸菌飲料 100 mL 中には、コロニー形成単位 1000 億個が含まれる。これは市販飲料に含まれる菌数と同じであった(気になる方は共同販売しているキリンさんの商品を検索してみて下さい)。
プラセボ飲料 100 mL は、JCM5805 株の乳酸菌飲料と同じ栄養構成(67 kcal、タンパク質 3.2 g、脂質 0.7 g、炭水化物 12 g)とのこと。
もう少し primary outcome について解析すると、
◯相対リスク RR:{7 / (106)} / {14 / (107)} = 0.066 / 0.131 = 0.504 50.4%
◯相対リスク減少率 RRR:1-RR = 0.496 49.6%
◯絶対リスク減少率 ARR:0.131 - 0.066 = 0.065 6.5%
◯治療必要数 NNT:1 / ARR = 1 / 0.065 = 15.38 16
であった。
乳酸菌飲料を摂取するだけで風邪やインフルエンザ(A 型 H1N1 のみ検討)の罹患や、一部症状の重症化を抑えられるのは良いかもしれない。しかも今回は 10 日間の摂取のみ。期間が延びれば効果差はさらに大きくなったかもしれない(変わらないかもしれない)。
アウトカム減少に至った詳細なメカニズムは依然として不明であり、本結果のみで JCM5805 株の乳酸菌飲料が pDC の活性化を引き起こし、(いわゆる)免疫力を高めるとは言えない。また一部の地域のみで認められた結果であり、アウトカム発生数も少なく絶対差は臨床的に意義があるのかと問われれば不明。
整腸作用もあわせて期待するなら摂取していても良いのでは?と思う。500 mL 入りペットボトルなら 100〜130 円くらい。実際、風邪ひいた時の咳と熱ツライもんね。
最後に気になったのが、謝辞の項に "Authors have no financial support or funding to report" との記載。しかし author にはキリン株式会社の社員が含まれているので、当然資金提供はキリン株式会社。このような記載方法は正しいのだろうか?汗
色々と書きましたが、私は毎日ヨーグルトを食べています。
⌘ 追加情報※
ssp. → subspecies 亜種のこと。subsp. とも標記される。
sp. → species 種小名のこと。
spp. → sp. の複数形。
非小細胞肺がんに対するニボルマブとドセタキセルの効果はどのくらい違いますか?(CheckMate 057)
PMID: 26412456
Funding: Bristol-Myers Squibb
ClinicalTrials.gov number: NCT01673867(プロトコールの途中変更あり→ Appendix のプロトコールに記載あり計 3 回、優越性が認められたため早期中止)
⌘ 背景
非扁平上皮性の非小細胞肺癌(NSCLC)患者における効果的な選択肢は、初回化学療法後に病態が進行する患者に限定されている。
(参照→ EBMの手法による肺癌診療ガイドライン2015年版:ガイドライン上の一次治療はプラチナ製剤やチロシンキナーゼ阻害薬が推奨されている。個々のエビデンスの吟味はできていない、というか時間かかりそうなので今回は勘弁)
(セカンドラインにおける)ドセタキセル推奨は、最善のサポートケアではなく生存期間の延長に基づいて進行性 NSCLC の治療の第 2 選択として承認された。
ドセタキセル(商品名:タキソテール→微小管重合阻害薬)よりも良好な副作用プロファイルを有するペメトレキセド(商品名:アリムタ→ジヒドロ葉酸レダクターゼ阻害薬)およびエルロチニブ(商品名:タルセバ→上皮成長因子受容体 EGFR 阻害薬)のような比較的新しい薬剤はドセタキセルよりも劣っている、あるいはセカンドラインとして使用された場合に全生存期間においてドセタキセルに対し優位性を示せなかった(非劣性)。
活性化T細胞上に発現する Programmed Death 1(PD-1)受容体は、腫瘍に発現したリガンド PD-L1 および PD-L2 が結合することにより、T細胞活性化がダウンレギュレーションされ、腫瘍は免疫逃避immune escape を促進する(つまり腫瘍細胞は免疫系による認識および排除を免れる)。
完全ヒト IgG4 PD-1 免疫チェックポイント阻害抗体であるニボルマブ(商品名:オプジーボ)は、PD-1 媒介シグナル伝達を破壊し、T 細胞の抗腫瘍免疫を回復させる可能性がある(低下した抗腫瘍作用を回復させる)。
第1相試験では、ニボルマブ単剤療法は耐久性のある抗腫瘍活性を示し、NSCLC サブタイプ全てにおいて生存率を向上させた(①Phase I study of single-agent anti-programmed death-1 (MDX-1106) in refractory solid tumors: safety, clinical activity, pharmacodynamics, and immun... - PubMed - NCBI、②Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. - PubMed - NCBI、③Overall Survival and Long-Term Safety of Nivolumab (Anti-Programmed Death 1 Antibody, BMS-936558, ONO-4538) in Patients With Previously Treated Adv... - PubMed - NCBI)。
重度前治療を受けている進行性非扁平上皮性 NSCLC 患者のうち、nivolumabは17.6% の反応率と関連しており、(投与後)1年で 42%、2年で 23%、3年で 16% の全生存率、および(投与後)1年で無増悪生存率 18%を示した(上記 ③ 文献結果)。
今回、進行性非扁平上皮性 NSCLC 患者において、ニボルマブとドセタキセルを比較した無作為化オープンラベル国際共同第 Ⅲ 相試験の結果を報告する。
⌘ PECOT
P:非扁平上皮性 NSCLC で平均 62 歳(range: 21-85)の男女 582 人
(組み入れ基準→ECOG※ が 0 あるいは 1 の患者。十分な血液学的、肝臓および腎機能を有する;中枢神経系への転移を有する患者は、転移が治療され安定していれば組み入れた。治療開始前に得られた腫瘍組織は、バイオマーカー分析に使用するのみで患者の選択には使用されなかった。NSCLC の IIIB期または IV期、放射線照射後の再発性非扁平上皮癌治療、外科的切除後の再発、進行期間中、以前にプラチナベースの 2 剤併用化学療法レジメンを 1 度だけ受けた患者。EGFR 変異または ALK 転座が既知の患者は、チロシンキナーゼ阻害剤療法の追加あるいは追加治療の選択、およびペメトレキセド、ベバシズマブ、またはエルロチニブへの治療切り替えは全ての患者に認められた)
(除外基準→自己免疫疾患、症候性間質性肺疾患、全身性免疫抑制、チェックポイント標的薬剤を含む免疫刺激性抗腫瘍剤による前治療、およびドセタキセルの事前使用)
I :ニボルマブ 3 mg/kg、2 週間毎に投与(最大投与可能回数:約 26 回/年), i.v.
C:ドセタキセル 75 mg/m2、3 週間毎に投与(最大投与可能回数:約 17 回/年), i.v.
O:primary - 全生存期間
secondary - 治験担当者が評価した奏効率、無増悪生存率、腫瘍 PD-L1 発現レベルによる有効性、および患者が報告したアウトカム
T:ランダム化比較試験(オープンラベル)
⌘ ランダム割付が隠蔽化されているか?(selection bias は無いか?)
以前に受けていた治療の影響が本試験結果に反映される可能性が高いため、以下 2 因子についての層別化を実施(この2因子については両群で同条件になるよう努めている)。Concealment については IVRS※ を採用しているため中央割付の可能性が高い。
→①以前の維持療法(Yes vs. No)および ②治療ライン(2ndライン vs. 3rdライン)
⌘ マスキングされているか?(ブラインドか否か?)
オープンラベル open-label
→疾患からブラインドで行うことは困難であり、費用面からも不適と考えられる。また薬剤によって投与期間が異なる。リアルワールドで肺がん患者がどんな治療を受けるか知らないことはほぼ無いだろう。
→治療薬による副作用の早期発見および早期治療、個々の薬剤毎に副作用が異なるためにオープンで実施したとの記載あり。
⌘ プライマリーアウトカムは真か?
真(全生存期間)
⌘ Baseline は同等か?
同等(インバランスについても記載有り)
⌘ 交絡因子は網羅的に記載されているか?
記載されている(他にもあるかも)
→大項目で 14 因子:年齢(中央値・範囲)、75歳以上の割合、性別(男性の割合)、人種(白人、アジア人、黒人、その他)、ECOG performance‑status score、肺がんステージ(ⅢB、Ⅳ)、喫煙歴※(Current or former smoker、Never smoked、Unknown)、EGFR 変異有り、ALK 変異有り、KRAS 変異有り、以前の維持療法、治療ライン、前治療レジメン(白金ベース、ALK 阻害薬、EGFR チロシンキナーゼ阻害薬)、最良効果判定(完全あるいは部分奏効、安定、進行、不明あるいは報告無し)
⌘ ITT 解析されているか?
されている。本文に記載有り。part of intention-to-treat
⌘ 追跡率(脱落)はどのくらいか?脱落率は結果を覆す程か?
Table 3 以外はニボルマブ 292 例 vs. ドセタキセル 290 例で解析。なので Figure 1 の結果については、脱落無しの追跡率100% で問題ないと考えられます。
また以下の項目も追記いたします。
追跡率は両群ともに 90% を超えているため問題ないと判断した。
◯ 二ボルマブ:追跡率 287/292 = 98.29%(脱落 5 例、1.71%)
(脱落の内訳:試験薬とは無関係な有害事象 1 例、組入基準から逸脱 4 例)
◯ ドセタキセル:追跡率 268/290 = 92.41%(脱落 22 例、7.59%)
(脱落の内訳:患者希望により治療中止 4 例、同意撤回 12 例、追跡不能 1 例、組入基準から逸脱 5 例)
⌘ サンプルサイズは充分か?
403 例の死亡時点で解析し優越性があれば中止。抗がん剤の場合、途中解析・優越性示唆による早期中止を想定しているため、推定必要例数に到達した時点で統計解析する(解析回数も予め設定している)。近年では The O’Brien–Fleming alpha-spending function※ を用いることが多いようである。途中解析を実施し最終解析にて P= 0.0408 未満で優越性が示されている(403 例死亡後に P= 0.047 未満であれば優越性有り)。
→ ドセタキセルの過去の試験結果から、262 例の死亡時点における有意差は両側 5%、power= 90、ハザード比= 0.72 と推定している。また 403 例の死亡が認められるであろう推定必要期間は約 25 ヶ月とのこと。本試験では中央値 12.2 ヶ月 時点において設定死亡数に達したものと考えられる。two-sided 5% significance level sequential test procedure with one interim analysis after 262 deaths (65% of total deaths) will have 90% power if the median OS times in docetaxel and BMS-936558 are 8 and 11.1 months (HR=0.72).
⌘ 結果は?
Primary outcome である薬剤投与 1 年後の全生存期間については統計学的有意差有り。
◯追跡期間中央値:
12.2 ヶ月(95% confidence interval [CI] 9.7-15.0)

(論文中の Figure 1 A より引用:legend は本文を参照)
◯全生存率:
二ボルマブ 51% (95% CI 45-56) vs. ドセタキセル 39% (同 33-45)
◯ハザード比(Hazard ratio, HR):
0.73(95% CI 0.59-0.89; P = 0.002)←本文では 96% になってる。間違い?
Secandary outcome
◯治験担当者が評価した奏効率※:
二ボルマブ 19%(95% CI, 15-24)vs. ドセタキセル 12%(95% CI, 9-17) P = 0.02
(完全奏効:ニボルマブ 4 人 vs. ドセタキセル 1 人)
◯無増悪生存率・期間(投与 1 年後):
二ボルマブ 19%(95% CI, 14-23)vs. ドセタキセル 8%(95% CI, 5-12)P = 0.02
二ボルマブ 2.3 months(95% CI, 2.2-3.3)vs. ドセタキセル 4.2(95% CI, 3.5-4.9)
HR = 0.92(95% CI, 0.77-1.1; P= 0.39)
◯腫瘍 PD-L1 発現レベルによる有効性(582 例中 455 例、78% がデータ有り):
PD-L1 の発現度合いにより治療効果が異なっている。サプリのデータだが、個人的には重要であると捉え掲載した。これを踏まえていれば CheckMate-026 の fail は無かったのではなかろうか。
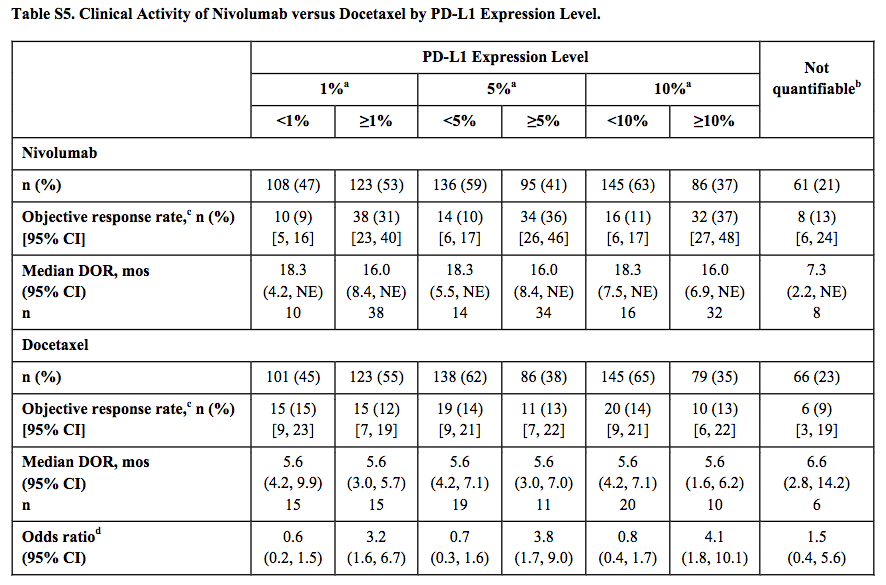
(論文中の Figure S5 より引用:legend は本文を参照)
DOR:duration of response
mos:months
◯患者が報告したアウトカム:
現在進行中との記載有り。Safety was assessed by an evaluation of the incidence of clinical adverse events and laboratory variables, which were graded according to the National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0. Select adverse events (those with a potential immunologic cause) were grouped according to prespecified categories. Analyses of patient-reported outcomes are ongoing.
⌘ 考察
Figure 1 の結果から、二ボルマブは投与開始 9 ヶ月後よりドセタキセルとの差が開き始めており、12 ヶ月後には有意な差を持って 27% 死亡リスクを低下させた。しかし、癌の進行割合においてはドセタキセルの方が少なかった。
Primary outcome についてもう少し詳しく見ていくと、
◯相対リスク RR:51/39 = 1.308(生存率なので 1 より大きい方が良い)
◯相対リスク減少率 RRR:(39-51)/39 = 0.308(30.8%)
◯絶対リスク減少率 ARR:51-39 = 12%
◯治療必要数 NNT:1/0.12 = 8.333 = 8 人 9 人(ここは切り上げでした。御指摘ありがとうございます)
◯治療期待オッズ(N 先生の受売り):1.27
という結果であった。Figure 1A の結果から、末期 NSCLC 患者へのニボルマブ投与により(ドセタキセル投与と比べ)2.8 ヶ月間寿命が延長する。ただし 24 ヶ月後にはニボルマブ投与群で 9 人、ドセタキセル投与群で 5 人の生存に留まった。ちなみに有害事象はドセタキセルに比べて二ボルマブの方が少なかった。
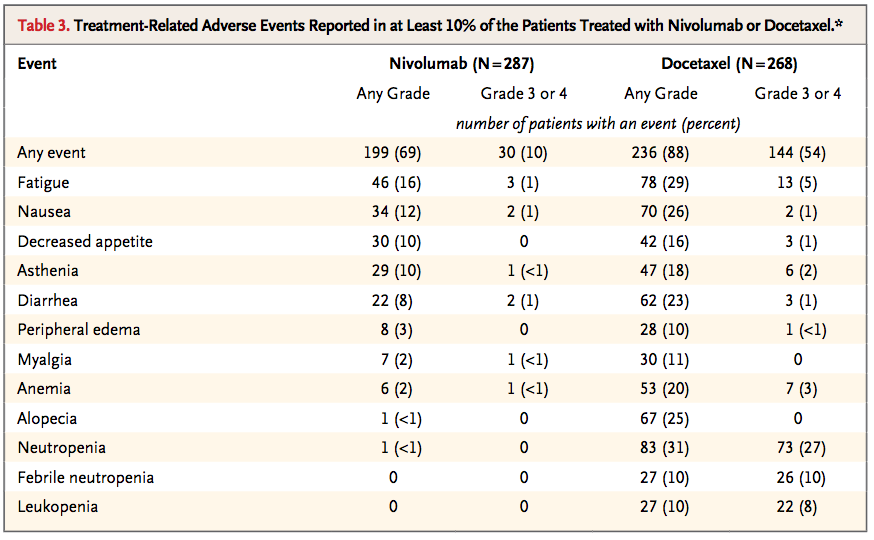
(論文中の Table 3 より引用:legend は本文を参照)
最後にコスト面(2017年 1月時点における薬価ベース:窓口での負担額では無い)についてだが、仮に身長 164 cm、体重 60 kg の成人に両薬剤を投与した場合、
20mg/2mL→ 150,200円(75,100円/mL)
100mg/10mL→ 729,899円(72,989円/mL)
→ 約 3500万円/年(2017年 2月には、この値より半額)
◯ドセタキセル(商品名:タキソテール)
20mg/mL:19,660円(ジェネリック医薬品 20mg/2mL:12,552円)
80mg/4mL:67,304円(ジェネリック医薬品 80mg/8mL:43,164円)
→約 178万円/年(ジェネリック医薬品:約 113万円)DuBois 式※を使用 1.651m2
⌘ 結論
末期 NSCLC 患者を対象としているため、個人的にはコストベネフィットは低く、やはりニボルマブは(半額になったとしても)高価であるなという印象(セカンドラインであることも留意)。ここは患者背景(家族や友人も含)により異なるため、ニボルマブ使用の是非を問いたいわけではありません。また抗がん剤治療は 2 剤以上の併用療法が多く、今後ニボルマブも併用療法に組み込まれる可能性は充分あると思っています。ただし、その場合、薬価をさらに下げなければ皆保険制度は崩壊しかねない(すでに崩壊しかけているかも?)。薬価下げすぎると安くて効果が高い薬剤が使われなくなる(メーカーが販売中止する)ので困る。報酬制度の見直しが迫られているのではなかろうか。それにしても抗がん剤はよく分からん。勉強を続けます。
→2017.2.5 追記:EBM-Tokyo のワークショップに参加してきました。論文結果の解釈や仮想症例に対するディスカッション等、非常に有意義な時間を過ごせました。そして EBM 実践においては論文の批判的吟味はそこそこで、多くの論文に触れることが重要であると感じました。なので、当面の目標は『 3 分くらい』で論文を読むことにします。
⌘ 追加情報※
① Eastern Cooperative Oncology Group (ECOG) performance-status score
| Score | 定義 |
|---|---|
| 0 | 全く問題なく活動できる。 発病前と同じ日常生活が制限なく行える。 |
| 1 | 肉体的に激しい活動は制限されるが、歩行可能で、軽作業や座っての作業は行うことができる。 例:軽い家事、事務作業 |
| 2 | 歩行可能で自分の身の回りのことはすべて可能だが作業はできない。 日中の50%以上はベッド外で過ごす。 |
| 3 | 限られた自分の身の回りのことしかできない。日中の50%以上をベッドか椅子で過ごす。 |
| 4 | 全く動けない。 自分の身の回りのことは全くできない。 完全にベッドか椅子で過ごす。 |
日本臨床腫瘍研究グループ(JCOG:Japan Clinical Oncology Group)より表を引用
原著:Common Toxicity Criteria, Version2.0 Publish Date April 30, 1999
https://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcv20_4-30-992.pdf
② O' Brien-Fleming 法
抗がん剤のような、市場から効果と承認スピードを求められている薬剤の場合、最終評価項目の解析を研究終了前に行い、予想以上の効果が観測された場合には研究を早期終了し、承認申請手続きに移行することがある。
Pocock 法等、他の方法より解析総数に依存せず、推定最終解析時における有意水準が比較的 0.05 に近く設定される。これにより他の方法に比べ最終解析における有意差が出やすくなるという利点がある。しかし研究開始に近い時点の中間解析では(早期であれば早期であるほど)有意水準が厳しく設定されることになるため試験の早期終了は期待できない。これは試験早期の小規模なデータのみで新薬を有効とする妥当性を担保することは困難であることと、小規模データのみでは医師等、専門家からの試験結果に対する支持を得られにくい為である。
③ 喫煙歴
Current smoker:現在、毎日喫煙あるいは特定の頻度で数日は喫煙している
Former smoker:過去100本以上吸ったが、現在は吸っていない
Never smoked:現在吸っていない(過去吸った本数100本未満)
④ 奏効率
⑦ IVRS (Interactive Voice Response System)
中央コンピュータにて割付をコントロールし、組み入れ患者は電話にて治療薬等の指示を受ける。選択バイアスやブラインド保持等、様々な試験方法に用いられている。またコスト削減や、患者情報をリアルタイムに入手できる等のメリットもある。
→ 似た方法に Interactive Web Response System (IWRS) があり、こちらは Web site で指示を受ける。
Proton Pump Inhibitor (PPI) の長期服用による精子への影響はありますか?(Fetil Steril 2016 Abstract only:charge)
PMID:27743698
⌘ 背景
これまでに Proton Pump inhibitor(PPI)長期使用により "認知症"、"低 Mg 血症"、"骨粗鬆症・骨折"、"ビタミン B12 の欠乏"、"鉄の欠乏"、"間質性腎炎"、"市中肺炎"、"感染性腸炎" 等のリスク増加が報告されている。しかし生殖機能への影響は不明である。そこで、妊娠を計画しているカップルのうち proton pump inhibitor 長期服用中の若い男性における精液パラメータへの影響を後向きに検討した。
⌘ PECOT
P case:精液検査を受けた若年男性 2,473 人のうち総運動精子数 total motile sperm count(TMSC)100 万以下の 241 例
P control:マッチする TMSC 100万超の 714 例
E:PPI の暴露
C:(PPI の暴露無し)
O:PPI 暴露および投与量
T:コホート内症例対症研究 Nested case-control study に相当する(Abstract には "Case-control study of a population-based registry" の記載有り)
⌘ 症例を集める基準は?偏りはあるか?(選択/抽出バイアスはあるか?)
オランダの人口データベース the Integrated Primary Care Information database(IPCI)* に登録されている 1996〜2013 年のデータを使用しており問題ないと考えられる。
⌘ 対象を集める基準は?偏りはあるか?(選択/抽出バイアスはあるか?)
Abstract からは不明だが、データベースよりマッチングを行っているため問題ないと考えられる。
⌘ 交絡因子の検討は充分か?(思い出し/情報バイアス等の測定バイアスはあるか?)
Abstract からは【年齢】および【PPI 以外の薬剤使用状況】の 2 点については検討されていることがわかる。他の因子については不明だが、一般診療記録を統合したデータベースを用いている、またデータベースに記録されたデータを用いていることからバイアスはほぼ無いと考えられる。
⌘ 結果は?
年齢と PPI 以外の薬剤使用を調整した結果、精液検査前 6〜12 ヶ月間の PPI 使用と低 TMSC のリスクは関連があり、オッズ比 2.96(95% confidence interval 1.26〜6.97)。一方、検査前 6 ヶ月以内の PPI 使用は、低 TMSC との有意な関係は示されなかった(詳細な値は Abstract に記載なし)。
⌘ 考察
6ヶ月〜 12 ヶ月の PPI 使用が総精子活動数 TMSC を低下させる、つまり精子の質低下との可能性が示唆された。これは年齢及び PPI 以外の薬剤使用について調整された結果であった。やはり PPI の漫然な長期処方の益は少なそうである。出来れば PPI 投与量等についても知りたかった。手持ちの情報だけでは因果推論までは出来なかった。今後の報告を待ちたい。
原著論文は有料であるため、ここからは推測だが TMSC 1×10^6 を基準にしているのは、この値未満の患者に対し『医師の約 90% が顕微授精**を勧める』という結果に基づいていると考えられる(Total motile sperm count: a better indicator for the severity of male factor infertility than the WHO sperm classification system. - PubMed - NCBI
PMID: 25788568)。
⌘ 追加情報
① 海外のデータベースをリストアップしているサイト:INTERNATIONAL SOCIETY FOR PHARMACOEPIDEMIOLOGY (ISPE)
② IPCI*:オランダ全土から選ばれた診療記録タイプのデータ(代表例としては家庭医 General Practitioner:GP の電子カルテ情報)を基にした長期観察研究用のデータベース。 主な登録情報は【生年月日】、【性別】、【患者 ID】 、【症状・診断名】、【処方薬剤】、【療法】、【入退院】、【身体所見】、【臨床検査値】など。GP のコンピュータから匿名化され毎月ダウンロードされている。疫学研究や薬剤疫学研究に用いられている。
③ 顕微授精**(ICSI:intracytoplasmic sperm injection):体外受精とは異なり、精子を直接卵子内に挿入する方法。他の治療法に比べ高価だが妊娠の可能性が高くなる。
低用量アスピリン服用患者においてテプレノン(防御因子増強薬)とラベプラゾール(PPI)は消化性潰瘍の再発を予防できますか?(PLANETARIUM study)
(PMID: 25100080)
⌘ 背景
消化性潰瘍の主な原因は、Helicobacter pylori(ピロリ菌)感染と薬剤の使用(NSAIDs や低用量アスピリン)である。
日本や米国、EU 等では、ピロリ菌感染およびピロリ菌による潰瘍は減少傾向にある。一方、薬剤誘発性の潰瘍は増加している。
健康者における [13 C] - アミノピレン呼気試験によって評価されたシトクロム450(CYP)活性に対する PPI の影響において、(日本で使用されている)標準用量でオメプラゾールおよびランソプラゾールは CYP 活性を阻害するが、ラベプラゾールは阻害しないことを示した。この知見は、ラベプラゾールが CYP2C19 および CYP3A4 に対して比較的影響が少ないことを明らかにしただけでなく、以前に報告された事実と一致している。
本研究では低用量アスピリン使用患者に対するラベプラゾールの消化性潰瘍の再発予防効果を検討した。また熱ショックタンパク質 70(HSP70)を誘導し NSAID 誘発胃病変に対する防御作用を有すテプレノンをアクティブコントロールとした。
⌘ PICO
P: 低用量アスピリン(low-dose aspirin, LDA 81 or 100 mg/day) 服用中かつ内視鏡下で消化性潰瘍を認めた 472 人(日本人のみ)
I : ラベプラゾール 10 mg(morning) + プラセボタブレット(5 mg 用、morning)+プラセボカプセル(3 times a day)
ラベプラゾール 5 mg(morning)+プラセボタブレット(10 mg 用、morning)+プラセボカプセル(3 times a day)
C: テプレノン 50 mg × 3 times a day + プラセボタブレット(5 mg 用、morning)+プラセボタブレット(10 mg 用、morning)
O: 24 週後の消化性潰瘍の再発(上部内視鏡検査)
⌘ 研究デザインは?ランダム化されているか?
ランダム化されている
randamized clinical trial
⌘ ランダム割付が隠蔽化されているか?(selection bias は無いか?)
されていると判断した
dynamic allocation+multi centre
⌘ マスキングされているか?(ブラインドか否か?)
マスキングされている
double-blind+triple dummy
⌘ プライマリーアウトカムは真か?
真であると判断した
⌘ 交絡因子は網羅的に検討されているか?
されていると判断した
大項目で15個:性別、年齢、虚血状態(狭心症、心筋梗塞、虚血性脳血管障害、CABG or PTCA、その他)、アスピリン用量、アスピリン服用期間、アスピリンを除く抗血栓薬の使用、H.ピロリ菌(陽性、陰性+潰瘍、陰性)、潰瘍(胃、十二指腸)、出血性潰瘍(胃、十二指腸)、前処置(PPI、H2Blocker、胃粘膜保護剤)、CYP2C19遺伝子型(PM、homoEM、heteroEM)、現喫煙、飲酒
⌘ Baseline は同等か?
同等
⌘ ITT 解析されているか?
以下 3 種類について検討
・FAS(Full Analysis Set:一度も介入を受けていない患者のみ除外)→基本的にはこの結果
・PPS(Per Prrotocol Set:プロトコールに従った患者のみ解析)→カプラン・マイヤー法で使用 Table 2
・SAS(Safety Analysis Set:
⌘ 追跡率(脱落)はどのくらいか?結果を覆す程か?
問題無し
ラベプラゾール 10 mg:142/158= 89.87%(10.13%)
ラベプラゾール 5 mg :138/156= 88.46%(11.54%)
テプレノン 150 mg :140/158= 88.61%(11.49%)
⌘ サンプルサイズは充分か?
計算されており、充分である
⌘ 結果は?
ラペプラゾール 10 mg および 5 mg 投与群の消化性潰瘍の再発率は、それぞれ 1.4% と 2.8% であり、いずれもテプレノン 150 mg 投与群(21.7%)より有意に低かった。
テプレノン 150 mg 投与群の 24 週間にわたる出血性潰瘍の累積発生率は 4.6% であったが、ラベプラゾール投与群(10 mg または 5 mg)においては出血性潰瘍は観察されなかった。
⌘ 考察
Funding の項に Eisai が満載過ぎるので気になるが、試験デザインはきちんとしていると考えられた(ちゃんと公表しているだけ良いか)。若干パラシュート試験のようにも思われるが、ラベプラゾールは日本で用いられている通常用量について検討されており、防御因子増強薬と比較し、PPI の効果を数値として捉える為に有用な結果であると考えられた。
低用量アスピリンには PPI の併用が有用であるとする結果であった。また倫理面で placebo 対象は難しいのだろうが気になる所。
基本的には FAS を用いているが、場合によっては PPS も使用しているので、いいとこ取りな印象もある。やはり Funding の影響か。
個人的には study name が好き。
構造主義科学論の冒険 著者:池田清彦
ある人に勧められて『構造主義科学論の冒険』を読んだ。
https://www.amazon.co.jp/構造主義科学論の冒険-講談社学術文庫-池田-清彦/dp/4061593323
以下、ただの個人的感想です。
・科学は観察可能なもの(見えるもの=現象)を不変の同一性(見えないもの=形式)によって言いあてようとするゲームであるP.15
→他の人にとっては何てこと無いただのコトバかもしれないが、私にとってはバットで頭を殴られたような、そんな衝撃的な出逢いだった。この一文に惹きつけられましたね。
ホン〇でっかTV にも出演していらっしゃる池田先生。失礼にも、ただの虫好きだと思ってました。
最近、脳を高速で掻き回されることが多く混乱と疲労でダウンしておりましたが、やっと歩き出せそうです(少し大げさに書きましたが風邪引いただけですw)。
私とは何者なのか?
何者なのかと悩む構造は何か?
薬剤師とは何か?
等々、またまだ考えたいことはありますが、ひとまず歩き出そうと思います。
別件ですが、引用と無断転載の線引きについて自分なりの解釈がまとまったので論文の批判的吟味も進めていきます。