Up-To-Date Evidence of DPP-4 inhibitors(Last UpDated: OCT 14th, 2017)
⌘ 背景
経口血糖降下薬である DiPeptidyl Peptidase-4 inhibitors(DPP-4阻害薬)のオマリグリプチンの非劣性ランダム化比較試験の結果が発表された(2017年)。これまでに発表されているアログリプチン(EXAMINE)、サキサグリプチン(SAVOR-TIMI53)、そしてシタグリプチン(TECOS)の結果も併せまとめておく。
⌘ 疑問
DPP-4阻害薬は 2型糖尿病患者における心血管アウトカムを抑制できるか。
⌘ 結果

https://www.ncbi.nlm.nih.gov/pubmed/?term=23992602
https://www.ncbi.nlm.nih.gov/pubmed/?term=23992601
https://www.ncbi.nlm.nih.gov/pubmed/?term=26052984
https://www.ncbi.nlm.nih.gov/pubmed/?term=28893244
https://www.ncbi.nlm.nih.gov/pubmed/?term=25765696
(表1. 各論文より作成 — プライマリーアウトカムは 3-point MACEである心血管イベントのみ)
⌘ コメント
倫理的観点から非劣性試験ばかりである。またプライマリーアウトカムである心血管イベントにおいて、プラセボ薬に対する非劣性は証明されたが優越性は示されていない。しかしメタ解析では心血管イベント発生に対する抑制効果が示唆されているものもある(後日アップ予定)。
血糖降下作用は、インスリンやスルホニル尿素薬に比べマイルド。そのため単独使用では低血糖症状をほぼ引き起こさないようだ。
FDAやEMAから課せられた課題はクリアしている。しかし真のアウトカムへの効果は不明。あとは誰に使うのか、真の課題は薬剤使用の個別化ではなかろうか。
エビデンスは "ナマモノ" である 〜AHEADMAP会報誌夏号〜
今回は雑記です。論文の批判的吟味ではありませんw
一次情報に触れることの重要性について AHEADMAP 会報誌夏号に寄稿しました!!
2型糖尿病の治療を例に、前提を疑うことや論文情報について紹介しています!(18ページを参照)
(もう3ヶ月くらい前です。そうですか、もう3ヶ月経ちましたか・・・)
AHEADMAPとは Association for Appropriate Healthcare Decision-making and Practice の略のようです。
で、これは何か?何をしているのか?
まず以下の基本理念を参照されたい。
Connect the New
〜エビデンスと人と、人と人とを繋ぎ、新しい価値と幸せを紡ぐ未来への地図〜
具体的には日常業務で Evidence-Based Medicine(EBM)を実践するために、また EBMという言葉が世の中から消え、当たり前の行動様式となるよう活動している チンドン屋!!(だと勝手に思っています)
私としては「新しい価値観の獲得」や「自身を俯瞰する」ために本会員として活動に参加しています。
ご興味のある方は是非、上記サイトからアクセスしてみて下さい♪
ーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーーー
私が論文に触れ、EBMを実践するためのきっかけを下さった方に本稿を捧げます。
薬剤師の未来に幸あれ
カナグリフロジンは 2型糖尿病患者の心血管・腎イベント発生を抑制できますか?(CANVAS program; NEJM 2017; Free→charge)
Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes.
N Eng J Med. 2017 Jun 12. doi: 10.1056/NEJMoa1611925. [Epub ahead of print]
Neal B et al.
PMID: 28605608
ClinicalTrials.gov No.: NCT01032629(CANVAS), NCT01989754(CANVAS-R)
【資金提供】
Janssen Research and Development
【利益相反COI or 開示disclosure】
http://www.nejm.org/doi/suppl/10.1056/NEJMoa1611925/suppl_file/nejmoa1611925_disclosures.pdf
【統合解析方法のペーパー】
PMID: 28244644
⌘ 結論
カナグリフロジンはハイリスク 2型糖尿病患者の心血管および腎イベントを抑制した。ただし日本での承認用量と異なる点、セカンダリアウトカムであっても下肢切断のリスク増加については慎重に検討する必要がある。従って同クラスの他の薬剤より優れているとは言いがたい。
⌘ 背景
カナグリフロジン(商品名:カナグル)は、糖尿病患者の血糖値、体重、およびアルブミン尿を減少させるナトリウム - グルコース共輸送体2(SGLT-2)阻害剤である。
心血管、腎臓、および安全性アウトカムに対するカナグリフロジン治療の効果を報告する。本論文は、CANVASおよび CANVAS-Rという 2試験の統合結果である。
⌘ RobotReviewerによる Risk of Bias Table

⌘ PICOTS
P: 心血管ハイリスク 2型糖尿病患者(罹患期間は平均 13.5 ± SD7.8年)
組入基準:HbA1c 7.0~10.5%の 2型糖尿病の男女、30歳以上で症候性アテローム性心血管疾患を有しているか 50歳以上で心血管疾患リスク(糖尿病罹患10年以上、収縮期血圧 140 mmHg以上で降圧薬を 1つ以上使用、喫煙、微小アルブミン尿あるいは顕性アルブミン尿、あるいは HDLコレステロール 1 mmol/L=38.7 mg/dL未満)を 2つ以上有す患者、eGFRが 30 mL/min/1.73 m2以上 etc.
除外基準:糖尿病性ケトアシドーシスの既往、1型糖尿病あるいは膵細胞移植、膵炎あるいは膵臓切除による糖尿病、スクリーニング前に治療薬および用量が少なくとも 8週間安定していない患者、ベースライン/Day1時の空腹時血糖 270 mg/dL(15 mmol/L)超あるいはスルホニルウレア剤またはインスリン使用中の患者の場合は空腹時血糖 110 mg/dl(<6mmol/L)未満、スクリーニング前 6ヶ月間に 1回以上の重症低血糖の既往 etc.
I :標準治療へのカナグリフロジン(商品名:カナグル)追加
CANVAS trial
→ カナグリフロジン 300 mg/day、100 mg/day、placeboの 3群
CANVAS-R trial
→ カナグリフロジン 100 mg/day(12週以降 300 mgまで増量可)の 2群
※300mgまで増加した患者は71.4%
※日本での承認用量は 100 mg/dayまで(2017年9月時点)
C: 標準治療への Placebo追加
O: Primary --- 心血管死、非致死性心筋梗塞、非致死性脳卒中の複合
Secondary --- ①全死亡、②心血管死、③アルブミン尿の進行(30%以上のアルブミン尿の増加および、正常アルブミン尿からの微小アルブミン尿あるいは顕性アルブミン尿への増悪、微小アルブミン尿からの顕性アルブミン尿への増悪)、④心血管死および心不全による入院の複合
T: 予防・治療、ランダム化比較試験、追跡期間 =188.2週(3.9年)
S: アジア-太平洋、北アメリカ、ラテン系アメリカ、ヨーロッパ諸国、その他
30ヵ国、667施設(少なくとも約20%がアメリカから参加と推定)
⌘ ランダム割り付けされているか?(観察者バイアスはないか?)
→ されている。Interactive Web Response System(IWRS)を採用
⌘ ブラインドされているか?(マスキングにより観察者バイアスは抑えられているか?)
→ されている。Double-blindだが検査値でバレバレな気はする(本文 Figure 1A参照)。2週間の run-in期間は single-blind(患者のみ)
⌘ 隠蔽化されているか?(選択バイアスはないか?)
→Concealmentの記載はないが、IWRSを採用していることから隠蔽化されていると判断(中央割付)。トライアルスポンサーであるヤンセンが実施しているところが少し気になる(気にしすぎ?)
⌘ プライマリーアウトカムは真か?明確か?
→ 真であるが複合であるため結果の解釈に注意が必要
⌘ 交絡因子は網羅的に検討されているか?
→ 概ねされている
⌘ Baseline は同等か?どんな患者背景?
→ 同等と判断。心血管疾患既往が 65.6%とハイリスクな集団であると考えられる。利尿薬の使用患者が 44.3%という点が個人的には気になる。内訳も知りたい。



(Table 1. 本文より引用)

(Table S4. Supplementary Appendixより引用)
⌘ ITT 解析されているか?
→ されている。
⌘ 追跡率(脱落)はどのくらいか?結果を覆す程か?
→ ITT解析であるため追跡率100%
試験完遂率はカナグリフロジン群 96.1% vs. placebo群 95.7%と同等
脱落は全体で4.19%(184+224 / 4163+5571)と問題なさそう。


(Figure S2. Supplementary Appendixより引用)
⌘ サンプルサイズは充分か?
→ 心血管セーフティ検討のために 688例のイベント発生が必要(β =90%パワー、αレベル =0.05)。しかしプライマリーアウトカムのイベント発生数は、CANVASでは 658(425+233)と足りず、CANVAS-Rを合わせた CANVAS program全体としては 1,011と充分。

(Table S6. Supplementary Appendixより一部引用)
→当初の計画では、CANVAS試験のみで 18,000例を予定していたが、第一段階の組入れ後に試験スポンサーが第二段階の被験者募集を中止することを決定した。そこで代替案として、アウトカムを腎臓病等に変更し、イベント発生抑制効果を検討する CANVAS-R試験を新たに計画した。


(Study Design Figures. Major study heralds new era in treatment of type 2 diabetes: CANVAS results available | The George Institute for Global Healthより一部引用)
⌘ 結果は?

(Figure 2A. Primary Outcome;本文より引用)
→3-Point MACE
ハザード比 =0.86(95%CI 0.75〜0.97)
P <0.001(非劣性)
P =0.02(優越性)

(Additional Figure 1. Primary Outcome発生数および追跡期間;本文より作成)

(Additional Figure 2. プライマリーアウトカムのNNTB; 本文より作成)

| *NNTB: Number Needed to Treat for Benefit |
| **NNTH: Number Needed to Treat for Harmful |
| ***MACE: Major Adverse Cardiovascular Events |
(Additional Figure 3. 本文より作成)
→プライマリーアウトカム、セカンダリーアウトカムの一部について、リスク比は増加した。個人的には驚愕の結果です。イベント発生率は両群で同程度なのに、ハザード比においてカナグリフロジン群はプラセボ群に比べ有意に低下。ちなみにですが EMPA-REG OUTCOMEでは、ハザード比(追跡期間を考慮)とリスク比(ある時点の値)は同じぐらいになります。気になる方は是非、算出してみてください。

(Figure 3. 本文より引用)
→アルブミン尿の進行
ハザード比 =0.73(95%CI 0.67〜0.79)
→eGFRの 40%低下、腎移植、腎不全
ハザード比 =0.60(95%CI 0.47〜0.77)


(Table 2. 有害事象; 本文より引用)

*NNTB: Number Needed to Treat for Benefit
**NNTH: Number Needed to Treat for Harmful
(Additional Figure 4. 安全性アウトカム;本文より作成)
→優位差のあった項目のみ記載。イベント発生数は不明。
⌘ 考察
はぁ〜、ドラクエ11クリアしちゃったのでブログ更新しちゃいました。ドラクエloss。いやはや、結果の解釈に自信が持てません。試験結果は正しいのか否か。
プライマリーアウトカムのイベント発生率がプラセボ群と同じ(Additional Figure 3参照)なのに、なぜ no. of participants per 1000 patient-yr では、カナグリフロジン群の方が低くなっているのか(Figure 3参照)。CANVASと CANVAS-Rそれぞれの追跡期間で補正してみましたが解明できませんでした(Additional Figure 2参照)。ここの部分、分かる方いらっしゃいましたら是非ともご教授願いたいです。
NNTB =218は no. of participants per 1000 patient-yr から算出していますので、そもそもの値が誤っている場合、意味をなさなくなります。あとセカンダリであっても下肢切断については留意した方が良いと考えます。一応、プライマリーアウトカムNNTB =218だとすると下肢切断リスクよりもベネフィットが上回ります。しかし同クラス薬はエンパグリフロジンがありますので、カナグリフロジンを選択する必要性は無いと個人的には思いました。
SGLT-2阻害薬の大規模臨床試験としては、ダパグリフロジンの DECLARE-TIMI58試験(Multicenter Trial to Evaluate the Effect of Dapagliflozin on the Incidence of Cardiovascular Events - Full Text View - ClinicalTrials.gov)が進行中です。Follow-upは 6年を予定しています。何気に楽しみ。
⌘ 追加情報
- アルブミン尿の基準(デザインペーパー参照)
Normoalbuminuria:尿中アルブミン/クレアチニン比(ACR*)が 30 mg/g未満
Microalbuminuria:ACRが 30~300 mg/g
Macroalbuminuria:ACRが 300 mg/g超
*ACR=Albumin Creatinine Ratio
SGLT2阻害薬は 2型糖尿病患者の全死亡リスクを低下できますか?〜Systematic Review & Meta Analysis〜(Acta Diabetol 2017; Charge)
Effects of SGLT-2 inhibitors on mortality and cardiovascular events: a comprehensive meta-analysis of randomized controlled trials.
Monami M et al.
Acta Diabetol. 2017 Jan;54(1):19-36. doi: 10.1007/s00592-016-0892-7. Epub 2016 Aug 4.
www.ncbi.nlm.nih.govPMID: 27488726
プロトコールは以下のサイトを参照:
http://www.crd.york.ac.uk/PROSPERO/display_record.asp?ID=CRD42015029573.
⌘ 私的背景
2017年7月23日に開催された EBM-Tokyoに参加し、上記の Systematic Review & Meta Analysis論文を読んだ。その際、RevMan5という Meta-Analysisの実施および作図を行えるソフトを使用し、本論文を吟味している先生に出逢い、触発され、自身でも試したくなった。再度、批判的吟味しつつ結果をまとめたい。
⌘ 結論
本論文の結果は 2015年 NEJMに掲載された EMPA-REG OUTCOMEの結果に引っ張られているため新規性は無く有用性も低い。SGLT-2阻害薬の有効性については依然として controversial。
⌘ PICOT
P: 2型糖尿病
I : Sodium-Glucose coTransporter 2 inhibitor (SGLT-2阻害薬)の使用
C: プラセボあるいは SGLT-2阻害薬以外の薬剤
O: principal --- 全死亡、心血管死
T: 予防・治療、ランダム化比較試験のシステマティックレビュー&メタ解析
⌘ 使用した文献データベースは何か?
MEDLINE(Pubmed)、Food and Drug Administration(FDA)、European Medicines Agency(EMA)、www.clinicaltrials.gov Web site(clinicaltrials.gov)
⌘ 検索語は?
SGLT-2 inhibitor(dapagliflozin, empagliflozin, canagliflozin, ipragliflozin, ertugliflozin, luseogliflozin)
⌘ 研究の種類は?
Randamized Clinical Trial(RCT)
⌘ 参考文献まで調べたか?
不明(それっぽい記載はあるが明確な記載無し)
⌘ 個々の研究者に連絡を取ったか?
本文に記載はないが、恐らく取っていない(論文 Fig.1参照)
⌘ 出版されていない研究も探したか?
探した(FDA、EMA、clinicaltrials.gov)
⌘ 同じ研究が複数報告されているか?
本文中に記載はないが、論文 Fig.1より排除されていると判断した
⌘ 英語以外で書かれた論文も探したか?
英語のみ(プロトコール論文参照)
⌘ 研究は網羅的に集められたか?(出版バイアスは無いか?)
概ね集められていると判断した(本文ファンネルプロットを参照)
⌘ 集められた研究の評価はどのように行われたか?(各研究の評価は妥当か?)
2人の研究者が独立して行い、意見が分かれたときは3人目が判断した
⌘ 評価基準は明確か?(Risk of Biasの評価基準は?)
明確(Cochrane Collaboration's toolを使用)
⌘ 研究の異質性は検討されたか?
I2 統計量を用い検討されているが表現が古い。P値が 0.1より小さい(つまり異質性が低い)か否かで表現されている。近年では I2=50%のように表現されることが多い
⌘ 最終的に残った研究数は?
71件、うち統合されたのは 32件(zero event studyを除外)
⌘ 結果は統合されたか?
統合された。基本的には Rondam-effect modelを使用
⌘ 結果は?
・全死亡 MH-OR =0.70 [95%信頼区間 0.59〜0.83], p < 0.001
・心血管死 MH-OR =0.43 [0.36〜0.53], p < 0.001
・心筋梗塞 MH-OR =0.77 [0.63〜0.94], p < 0.01
・脳卒中 MH-OR =1.09 [0.86〜1.38], p = 0.50

Fig.1 全死亡のフォレストプロット(RevMan 5 | Cochrane Community
を使用し作成:計 32件の RCTを統合)
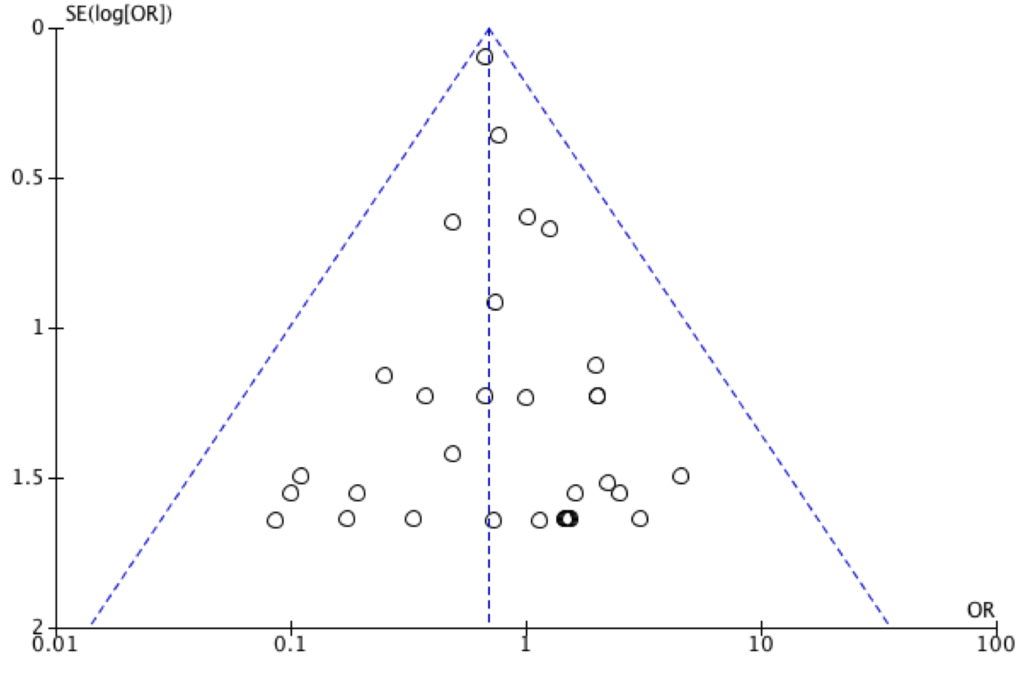
Fig.2 統合された 32件の RCTを用いたファンネルプロット(論文中には 71件の RCTの結果が記載されている)
⌘ コメント
Fig.1をみてみると Weight、つまり統合された結果に対する各研究の重み付けは Zinman (1が 77.1%と一番多い。この研究が EMPA-REG OUTCOMEである。つまり本論文の結果は、1つの大規模な RCTに引っ張られているだけであり、新規性は乏しい。
そして EMPA-REG OUTCOMEを取り除いた結果が以下である。
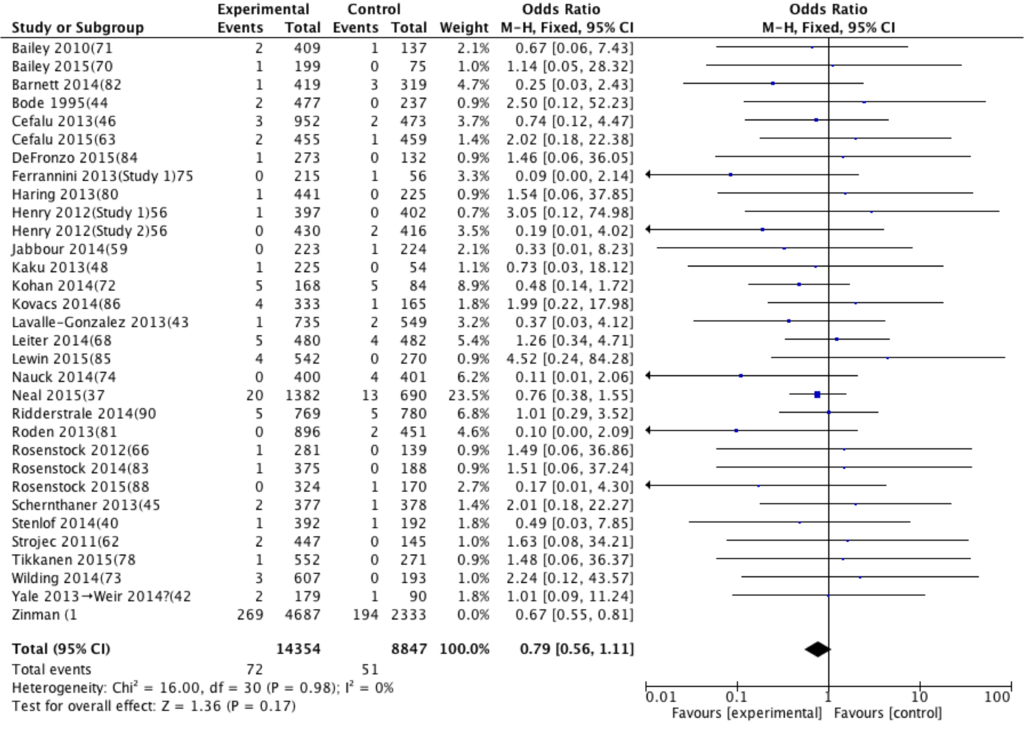
Fig.3 EMPA-REG OUTCOMEを取り除いた全死亡の統合結果(計 31件)
EMPA-REG OUTCOMEを統合してもしなくても異質性は 0%だが、取り除いたことでオッズ比が 1をまたいでしまった(OR =0.79, 95%CI 0.56〜1.11)。
1件の RCTの結果のみ(今回の場合は EMPA-REG OUTCOME trial)では薬剤効果を判定するのは難しいと考えられる。つまり現時点では SGLT-2阻害薬使用により全死亡のリスク低下は44%あるかもしれないし、逆にリスクを11%増やしてしまうかもしれない(SGLT-2阻害薬は使わないようにしましょう!とは言っていません。誰に使うかは非常に悩ましいところ)。
SGLT-2阻害薬の有効性については、新たな研究結果が待たれる(CANVAS programについては後日アップ予定です)。
また本論文の作成過程が "正確に" 行われたのかについては非常に疑問です。引用先の参考文献の番号が異なっていたり、参考文献には記載のない著者名が本文中に記されていたり、principal outcome以外の異質性が記されていなかったり、集めてきた研究の Risk of Bias評価が誤っていたり等々、てんこ盛りです。本論文の筆頭著者は、糖尿病研究ではかなり有名な人物のようですが、非常に残念でなりません。
ちなみに EMPA-REG OUTCOME trialに対する批判的吟味はこちらにありますので、よろしければ、ご参照ください。
CANVAS Programの批判的吟味についてはこちら ↓ ↓
2型糖尿病治療における血圧や脂質、血糖コントロールはどのように行いますか?ほどほどでも何とかなりますか?(後向きコホート研究; PLoS One. 2014; Free)
All-Cause Mortality in Patients with Type 2 Diabetes in Association with Achieved Hemoglobin A1c, Systolic Blood Pressure, and Low-Density Lipoprotein Cholesterol Levels
PLoS One. 2014 Oct 27;9(10):e109501. doi: 10.1371/journal.pone.0109501. eCollection 2014.
Chiang HH et al.
www.ncbi.nlm.nih.govPMID: 25347712
【背景】
2型糖尿病患者におけるヘモグロビンA1c(HbA1c)および収縮期血圧(SBP)、低比重リポタンパク質コレステロール(LDL-C)のコントロールについてはあまり明らかではない。本研究では、各々のコントロール幅と死亡率との関連性を明らかにする。
【結論】
2型糖尿病患者の死亡率と、血圧や脂質、血糖コントロールとの間には J-curve現象が認められた。本研究は retrospective cohort studyであるため、未知の交絡因子を完全には調整・排除できてはいない。しかし個人的には、本研究結果から厳格な治療の益は少ないと感じた。
【PICOTS】
P: 18歳以上の 2型糖尿病患者 12,643名
組入れ基準→ コホートデータ内で、外来性糖尿病診断(ICD-9:250)および糖尿病の最初の外来患者来院 6ヶ月間に処方された経口血糖降下剤またはインスリンを含む薬剤処方を含むように同定。Index Date は糖尿病と診断された外来診察の初日から半年後の日付として定義された。最終的な糖尿病コホートは合計 17,837人の患者から成っていた。原因究明の全死亡が発生するまで、それぞれの Index Dateから追跡調査した。死亡が記録されていない場合、検閲の日付は研究の終了日(2010年12月31日)として定義された。研究プロトコルは、極東記念病院の研究倫理委員会によって承認され、インフォームドコンセントの必要性を放棄した。プロトコル番号:100073-F。
除外基準→ それぞれの Index Date後に少なくとも 12ヶ月の追跡調査を受けていない患者は、研究から除外された。ベースライン期間は、糖尿病の最初の外来診察から Index Dateまでの 6ヶ月として定義された。また Index Date 時に 18歳未満の患者あるいは 1型糖尿病患者を除外した。 1型真性糖尿病は、ICD-9:(250.x1または 250.x3)および致命的疾患登録カードによって同定された。
I : 3因子(HbA1c、SBP、LDL-cholesterol)の層別化
C: (ー)
O: 全死亡
T: 後向きコホート研究retrospective cohort study、予測ルール
S: セッティングは 1ヵ所 --- 台湾の新台北市にある極東記念病院(2002年〜2010年に作成)
⌘ 追跡期間は?
平均追跡期間 =5.6±2.4年
糖尿病による "死亡" を観察するのに、まぁ妥当ではないでしょうか。
⌘ 結果に及ぼす程の脱落はあるか?
無し。全てのアウトカムに反映されている。
⌘ アウトカムの観察者はマスキングされているか?(危険因子は既知であったか)
されていない。ハードエンドポイントであるため、個人的にはマスキングの必要は無いと思います。
⌘ 交絡因子の調整は?
多変量解析(潜在的交絡因子の調整を実施)→Cox比例ハザードモデル
⌘ コホートの背景は?

(Table 1:本文より引用)
⌘ 結果は?
Figure 2のインパクトが大きいので以下に引用します。観察期間中に死亡したのは 1,278人であり、これは全体 12,643人の 10.11%であった。本研究の 2型糖尿病コホートにおいて、HbA1c 7.0〜8.0%、SBP 130〜140 mmHg、または LDL-C 100〜130 mg/dLの患者の全死亡率が最も低い値を示した。 これらの関連性を確認し、詳細なメカニズムを追調査するためには、さらなる研究が必要である。
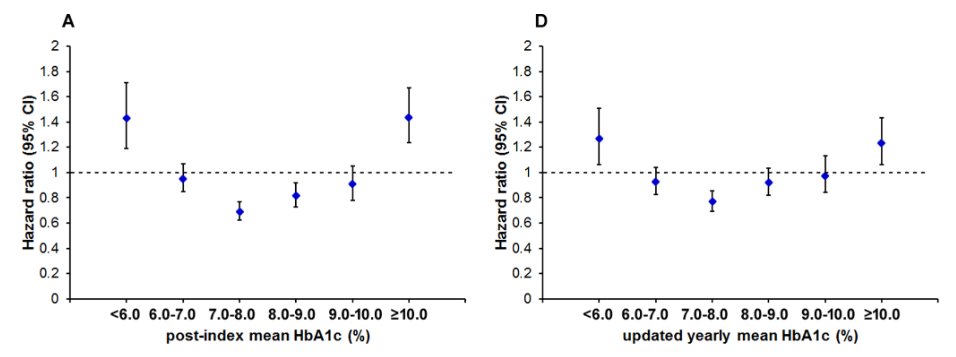
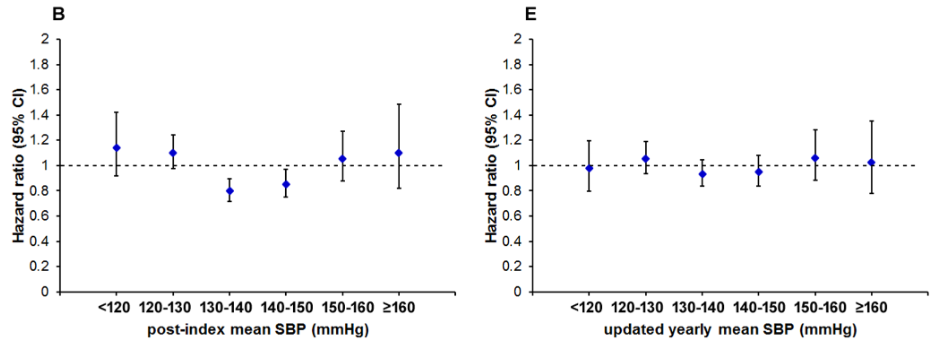
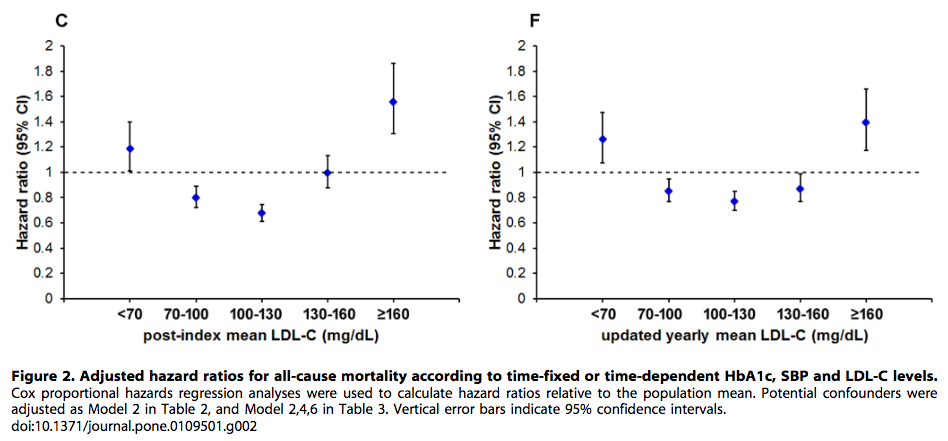
(Figure 2:本文より引用)
⌘ 研究の限界
①ランダム化していないため、未知の交絡因子を内包している
②喫煙歴、BMI、併存疾患の家族歴を完全には把握できていない
③パラメータの欠損があり、なかでも LDL-コレステロールのデータ欠損は 27.8%
④Taiwan National Register of Deathsにおいて特定の死亡原因は、ICD-9(2002-2007)およびICD-10(2008-2009)のコードに分類され、30.8%の死亡が糖尿病(ICD-9:250、ICD-10:E10-E14)に分類された。したがって分類システムは、追調査を行う上での正確性は充分ではない。
⌘ コメント
興味深い研究。前向き研究はあるのでしょうか。前向き研究の結果と相関があれば、より強固なエビデンスとなりそう。あら、より強固にする必要はないか。とにかく真理らしいものに触れてみたい。結局は触れられないのだけど。
個人的には、高齢者で「食べるものがない。血糖値上がるのが怖い。」と嘆いている HbA1c =6%代の患者さんに紹介したいデータです。
ハイリスク高血圧患者における血圧コントロールのファースト・ラインは利尿剤?(ALLHAT trial; JAMA 2002; Free)
Major Outcomes in High-Risk Hypertensive Patients Randomized to Angiotensin-Converting Enzyme Inhibitor or Calcium Channel Blocker vs DiureticThe Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT)
The ALLHAT officers and coordinators for the ALLHAT collaborative Research Group.
JAMA. 2002 Dec 18;288(23):2981-97.
www.ncbi.nlm.nih.govPMID: 12479763
【財務開示Financial Disclosures】
→本文 pp.2994参照
⌘ 結論
ハイリスク高血圧患者における降圧療法のファーストラインは利尿薬。次いで Ca拮抗薬である。心血管アウトカムに対する利尿薬の効果は他剤と比較し誤差範囲とも捉えられるが僅かなアドバンテージがある。さらにコスパの良さが本結論を導くきっかけになったと考えられる。
⌘ 私的背景
高血圧ガイドライン2014では Ca拮抗薬、ACE-I/ARB、利尿薬での治療開始が推奨されている。一方、2009年には α遮断薬、2014年には β遮断薬が高血圧ガイドラインの推奨から外された。そのきっかけとなったのが ALLHAT trialおよび LIFE trialである。
SNSで質問をいただいたので ALLHAT trialを改めて読んでみた。質問内容は以下 5点。
①患者Patientはハイリスクと捉えて良いか?
②プライマリ・アウトカムに差がないため、著者の結論は言い過ぎではないか?(利尿薬をファースト・ラインとすべきという主張)
③併存疾患のない高血圧患者のファースト・チョイスを利尿薬とするのは、2009年に発表されたコクランレビュー(CD001841、PMID: 19588327)の結果を受けてなのか?
④プライマリ・セーフティ・アウトカムで消化管出血gastrointestinal bleedingの項目があるのはなぜか?
⑤脱落率は 3%で良いか?
本試験の目的は高血圧症に関連する冠動脈疾患coronary heart disease(CHD)あるいは心血管疾患ccardiovascular disease(CVD)イベントの発生率について、カルシウムチャネル拮抗薬calcium channel blocker(CCB、Ca拮抗薬)のアムロジピン(商品名:ノルバスク、アムロジン)、アンギオテンシン変換酵素阻害薬angiotensin-converting enzyme inhibitor(ACE-I)のリシノプリル(商品名:ロンゲス、ゼストリル)、そしてサイアザイド系類似利尿薬thiazide-like diureticの chlorthalidoneを比較した。ハイリスク高血圧患者における血圧コントロールのファースト・チョイスは何か?という問いに対する答えを示した試験の 1つ。
個人的には本試験結果を、血圧低値の高齢患者や起立性低血圧症を有す患者に対し処方介入を行う際に使用している。
⌘ 質問に対する私見
①患者Patientはハイリスクと捉えて良いか?
→ 患者背景(本文 Table.1参照)から、心血管疾患の既往が約50%、糖尿病の既往が約35%、そして CHDの既往が約20%ずつ含まれているためハイリスクと捉えても良いと思います。
②プライマリ・アウトカムに差がないため、著者の結論は言い過ぎではないか?(利尿薬をファースト・チョイスにすべきという主張)
→ 本文 Figure.3より主要効果については確かに差がありません。また脳卒中や心不全(本文 Figure. 4参照)以外は同等であるため過大解釈ともとれますが、リスクやコスト、過去の臨床試験結果を含め総合的に判断すると、利尿薬が血圧コントロールにおいてファースト・チョイスに成り得ると個人的には思います。しかし御指摘の通り、本試験結果のみで利尿薬が一番良いというのは言い過ぎだと思います。この点については、著者も認識しており「3剤のうち降圧効果が最も強く、心血管イベント抑制効果や治療忍容性、そして低コストであるため初期治療に利尿薬を用いるべきである。しかし、これは循環器が正常な場合であり、異常な場合は Ca拮抗薬あるいは ACE-Iで治療を開始する必要がある」と主張しています。
ちなみにですがガイドラインでは、利尿薬をファースト・チョイスとは明記しておらず、ファースト・ラインとして、4クラス横並びにしています(糖尿病や骨粗鬆症の場合は別ですが、これもあくまでガイドラインによる推奨です)。
当時、本試験に用いられた薬剤の中で利尿薬は、いわゆる従来薬と呼ばれていました。一方、Ca拮抗薬や ACE-I、特に ARBは新薬と持て囃され、(特に従来薬の β遮断薬と比べて、という意味でですが)その降圧効果の高さから心血管疾患イベント抑制に期待が寄せられていました。しかし、その後の臨床試験結果から低用量利尿薬が、他剤と比較し有効であるとする試験結果が報告されはじめました。利尿薬は歴史が長いことから安全性情報が多く、かつ低用量ならば電解質異常等に伴う副作用が起こりづらく、さらには低コストであるため、他剤と比べてベネフィットが多いと考えられます(もちろん低カリウム血症には注意が必要です)。
以上のことから、患者背景には注意する必要がありますが、クロルタリドンの安全性及び有効性は高く、私個人としては利尿薬、特にクロルタリドンを降圧療法の第一選択にしても良いと思います(日本ではクロルタリドン販売中止になりましたが)。
③併存疾患のない高血圧患者のファースト・チョイスを利尿薬とするのは、2009年に発表されたコクランレビュー(CD001841、PMID: 19588327)の結果を受けてなのか?
→ 上記でも少し触れましたが、あくまでガイドライン上では、4クラスは横並びだと認識しております。また治療選択は患者背景によりますので、何をもって第一選択とするのか?について各々が継続的に考えていくことが重要であると思います。個人的には日本人において低用量利尿薬をファースト・チョイスにしても良いと考えていますが、こちらのエビデンスについてはまた別の機会に。
ついでと言ってはなんですが、この文献(https://www.ncbi.nlm.nih.gov/pubmed/25577154)を読んでみるのも良いかも。
④プライマリ・セーフティ・アウトカムで消化管出血gastrointestinal bleedingの項目があるのはなぜか?
→ 本文 pp.2989 に以下の記載があります。Ca拮抗薬、特にジヒドロピリジンDHP系の薬剤は「腫瘍リスク」、「消化管出血」、「全死亡」増加の可能性が過去の研究で示唆されているようです。従って本試験においても安全性の項目に入れたようです(結果としては 3群間で差がなかった)。以下、本文より一部抜粋。
A body of literature based on observational studies and secondary CHD prevention trials of short-acting CCBs has suggested that CCBs, especially DHP-CCBs, may increase the risk of cancer, gastrointestinal bleeding, and all-cause mortality.
⑤脱落率は 3%で良いか?
→ 良いと思います。一応、追跡率の項に記載します。
⌘ RobotReviewerによる Risk of Bias Table

⌘ PICOT
P: 55歳以上かつ冠血管疾患リスクを 1つ以上有す患者 33,357人
I : Ca拮抗薬 アムロジピン 2.5〜10 mg/日(n =9,048)
ACE-I リシノプリル 10〜40 mg/日(n =9,054)
C: チアジド系類似利尿薬 chlorthalidone 12.5〜25mg/日(n =15,255)
O: primary --- 致死的 CHDあるいは非致死的心筋梗塞の併発
T : 平均追跡期間 4.9年、ランダム化比較試験、予防、北アメリカの 623施設
⌘ ランダム割り付けされているか?(観察者バイアスはないか?)
→ されている。ランダム化比較試験。
⌘ ブラインドされているか?(マスキングにより観察者バイアスは抑えられているか?)
→ されている。Double-blind, active-control(個人的にはプラセボに対する効果も知りたいところ)。
⌘ 隠蔽化されているか?(選択バイアスはないか?)
→ されている。
The concealed randomization scheme was generated by computer, implemented at the clinical trials center, stratified by center and blocked in random block sizes of 5 or 9 to maintain balance. Participants (n = 33 357) were recruited at 623 centers in the United States, Canada, Puerto Rico, and the US Virgin Islands between February 1994 and January 1998. (The original reported number of 625 sites changed because 2 sites and their patients with poor documentation of informed consent were excluded.) All participants gave written informed consent, and all centers obtained institutional review board approval. Follow-up visits were at 1 month; 3, 6, 9, and 12 months; and every 4 months thereafter. The range of possible follow-up was 3 years 8 months to 8 years 1 month. The closeout phase began on October 1, 2001, and ended on March 31, 2002.
⌘ プライマリーアウトカムは真か?明確か?
→ 真だが、複合アウトカムに注意。
⌘ 交絡因子は網羅的に検討されているか?
→ 概ねされていると考えられる(本文 Table.1参照)
⌘ Baseline は同等か?
→ 群間での大きな偏りは無いと考えられる(本文 Table.1参照)
⌘ ITT 解析されているか?
→ されている。
⌘ 追跡率(脱落)はどのくらいか?結果を覆す程か?
→ アムロジピン :脱落率 =2.75% --- 1-(15,255-339-80)/15,255
リシノプリル :脱落率 =2.85% --- 1-(9,048-200-58)/9,048
クロルタリドン:脱落率 =3.05% --- 1-(9,054-218-58)/9,054
⌘ サンプルサイズは充分か?
→ 充分。各群 8,500〜15,000例あれば良い。
ALLHAT was designed with a large sample size (9,000〜15,000 participants/intervention arm) and long follow-up (4-8 years).
In Formula (1), n0 and n 1 are the sample sizes in the diuretic and another AH arm, respectively, and p0 and p1 are the observed proportion of events in those arms. For the optimal allocation of patients, n0=40,000[%3/(3+%3)]=14,641 and n1=40,000[1/(3+%3)]=8,453. We will reject if the Z statistic exceeds the adjusted critical value c=2.37. If we denote the cumulative normal distribution function by Φ(x), power can be shown to be: Z=arcsin( pˆ0)arcsin( pˆ1). (1) (1/4)(1/ n0 +1/ n1 )
⌘ 結果は?
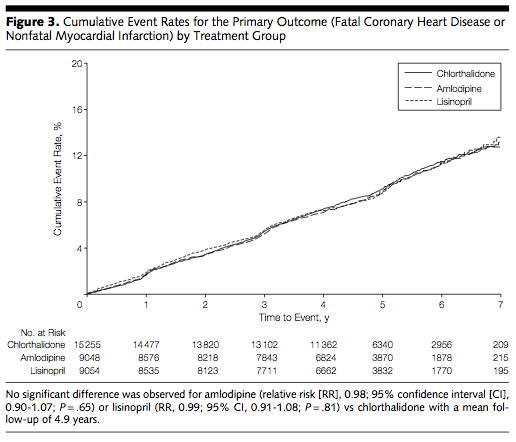
(Figure.3:本文より引用)
→ 3群間で差はなかった。 つまり患者背景により、どの薬剤を使用しても良いということではないでしょうか。症例数からフォローアップ 5年以降の結果は信頼性が低いと考えられる。
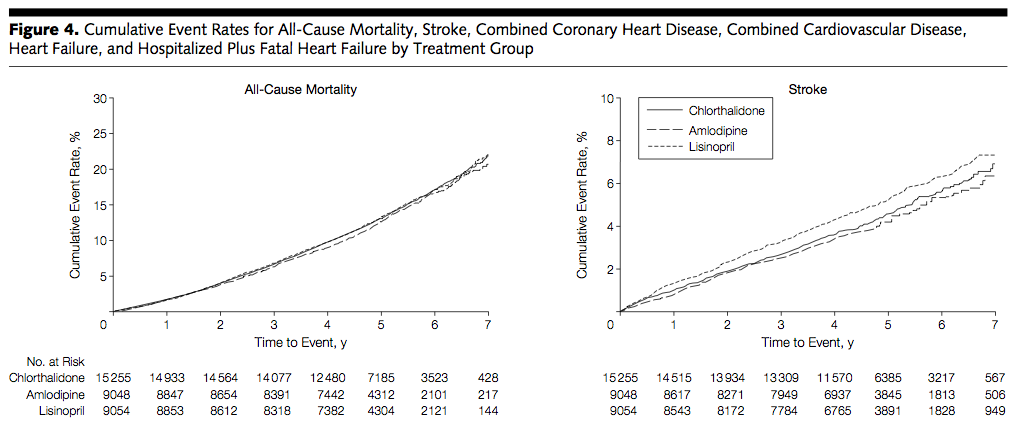
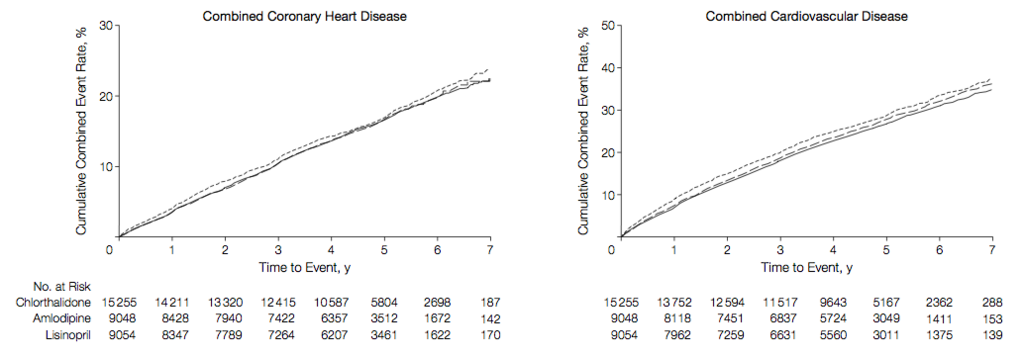
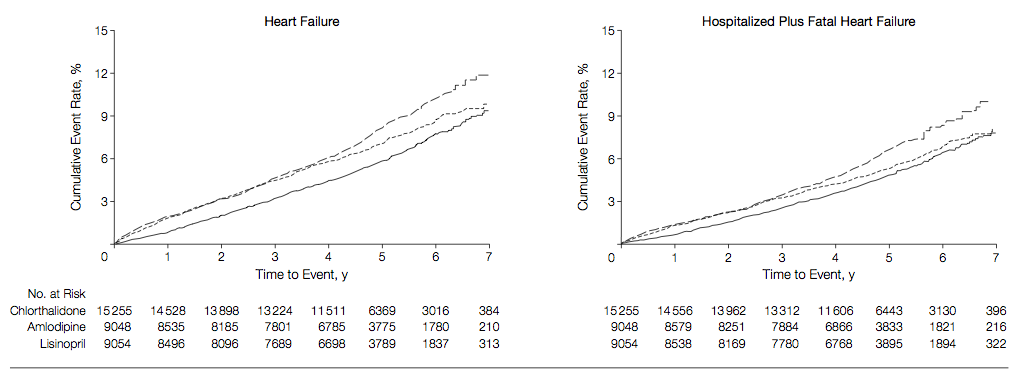
(Figure.4:本文より引用)
→ 脳卒中においては、リシノプリルでの発生率が他の 2群に比べて高かった。心不全および心不全による入院については、クロルタリドンで僅かなベネフィットがありそう。アムロジピンとリシノプリル間の差は少ないと考えられる。ただしプライマリーではないため、あくまで仮説生成であることに注意。
⌘ 考察および追加情報
①ドキサゾシン投与群については早期中止
→ ALLHAT trialは当初、α遮断薬を含めた 4群での比較だった。しかし利尿薬と比べ、α遮断薬投与群ではプライマリーエンドポイントおよび死亡率に差はなかったが、下記のリスク増加が認められたため早期中止された(平均追跡期間 3.3年)。
脳卒中リスク:RR =1.19, 95%CI =1.01〜1.40, P=0.04
複合 CVD(4-year rates):RR =1.25, 95%CI =1.17〜1.33, P<0.001
CHFリスク(4-year rates):RR =2.04, 95%CI =1.79〜2.32, P<0.001
狭心症:RR =1.16, P<0.001
冠動脈再建術:RR =1.15, P=0.05
②クロルタリドンchlorthalidone(商品名:ハイグロトン、日本では販売中止)とは?
→ サイアザイド系類似薬。ノバルティス・ファーマ社から発売されていたが、2001年10月1日に製造中止が発表され、2008年に販売中止されました。
高齢者を対象とした SHEP trialでも使用されました(Prevention of stroke by antihypertensive drug treatment in older persons with isolated systolic hypertension. Final results of the Systolic Hyperte... - PubMed - NCBI)。
ちなみに N先生はノバルティス・ファーマ社に対して「ハイグロトンの販売を再開せよ」的なことをメールで伝えたそうです。行動力、すごい。
③薬価比較
→ ハイグロトン錠 50mg --- 12.1円/錠(2008年10月時点:オレンジブック掲載)
ノルバスク錠 2.5〜10 mg --- 26.7〜73.8円/錠(2017年6月時点)
ロンゲス錠 10〜40 mg --- 62.1〜243.0円/錠(2017年6月時点)
カルデナリン錠 2〜8 mg --- 51.4〜388.8円/錠(2017年6月時点)
以上、ほとんど私見ですが利尿薬のベネフィットは大きいと考えられます。大事なことなので何度も言いますが患者背景により推奨やエビデンスは表情を変えると想います。
エンパグリフロジンは2型糖尿病患者の心血管イベントを抑制できますか?実はオープンラベルですか?(EMPA-REG OUTCOME: NEJM.2015 Free)
Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes.
Zinman B et al.; EMPA-REG OUTCOME Investigators.
N Engl J Med. 2015 Nov 26;373(22):2117-28.
www.ncbi.nlm.nih.govPMID: 26378978
ClinicalTrials.gov No.: NCT01131676
【資金提供】
ベーリンガー・インゲルハイムBoehringer Ingelheim
イーライ・リリーEli Lilly
【利益相反COI or 開示disclosure】
めっちゃある(本文参照)。個人的には "The trial was designed and overseen by a steering committee that included academic investigators and employees of Boehringer Ingelheim." という部分がかなり気になる。
⌘ 結論
標準治療へのエンパグリフロジン追加はハイリスク 2型糖尿病患者における心血管死を抑制した。
ただしブラインドが破綻している可能性と奇妙な試験結果、患者背景から日本人への外挿は慎重に行う必要があると考えられる。
→2017.5.16追記
⌘ 私的背景
先日 EBM勉強会に参加し本論文を読んだ。その中で気になった点がいくつかあったので再度、批判的吟味しつつ考えをまとめてみる。
⌘ RobotReviewerによる Risk of Bias Table

⌘ PICOT
P: 18歳以上の 2型糖尿病患者 7020例。心血管疾患の既往歴あり
(組入れ基準:BMI 45以下, eGFR 30 mL/min/1.73m2以上, ランダム化前の 12週間血糖降下薬を飲んでいない状態でHbA1c 7.0~9.0%,あるいは血糖降下療法を受けている安定した状態で HbA1cが 7.0~10.0%。
除外基準:早朝空腹時血糖 240mg/dL以上、肝疾患、組入れ前 3ヶ月以内に心臓手術や血行再建術が予定されている患者、eGFR 30 ml/min/1.73m2未満、減量手術、血液疾患、癌の既往歴、本薬を含め治療薬使用が禁忌の患者、抗肥満薬使用、全身性のステロイド使用、甲状腺ホルモンのタイトレーションを行っている患者、状態が不安定な内分泌疾患を有す患者、妊婦・授乳婦、アルコール依存・薬物依存、他臨床研究に参加中の患者、臨床的症状不良な患者、急性冠症候群・脳卒中・一過性脳虚血発作を有す患者)
I : 標準治療へのエンパグリフロジン(商品名:ジャディアンス)10 mg あるいは 25 mg
C: 標準治療へのプラセボ追加
O: primary --- 3-point MACE
(心血管死、無症候性心筋梗塞を除く非致死性心筋梗塞、非致死性脳卒中)
key secondary --- primary outcome + 不安定狭心症による入院
T : ランダム化比較試験、プラセボ対照、非劣性試験(FDA勧告に従いマージン1.3)、
優越性についても検討(マージン1.0?記載無し)、追跡期間は中央値 3.1年(治療期間は 2.6年)
⌘ ランダム割り付けされているか?(観察者バイアスはないか?)
→されている。IVRS(Interactive Voice Response System)および Interactive Web Response System(IWRS)を採用。
→層別割り付けを実施。
HbA1c:8.5%未満、8.5%以上
BMI :30未満、30以上
eGFR :30~59、60~89、90以上(ml/min/1.73m2)
居住地 :北米(+オーストラリア+ニュージーランド)、ラテンアメリカ、ヨーロッパ、アフリカ、アジア
⌘ ブラインドされているか?(マスキングにより観察者バイアスは抑えられているか?)
→一応されている。破綻している可能性については後述。ハードエンドポイントだからそこまで影響無いかもしれない。
⌘ 隠蔽化されているか?(選択バイアスはないか?)
→されていると判断。中央割り付けであるため。
⌘ プライマリーアウトカムは真か?明確か?
→真であると判断した。ただし複合エンドポイントである点を考慮する必要がある。
⌘ 交絡因子は網羅的に検討されているか?
→概ねされていると判断した。CRPや BNPがあっても良いかも。
あとウエストサイズ。←あかん。これはエビデンスなかった(2017.5.16追記)。
⌘ Baseline は同等か?
→概ね同等であると判断した(Appendix Table S2参照)。
⌘ ITT 解析されているか?
→改変 ITT解析。最初は 7028例だったが、結果は 7,020例の解析だった。Full Analysis Set(FAS)である。
⌘ 追跡率(脱落)はどのくらいか?結果を覆す程か?
→FASだとほぼ100%(99.89%)。一応、脱落率を算出すると、2割を超える(追跡率 8割を切っている)ので脱落が多い気はする。リアルワールドではこのぐらいなのかな?非劣性試験のため Per Protocol Analysis(PPA)との比較も重要だが、この程度の脱落ならば差はなさそうである。
5,029 / 7,020 =71.6%(Appendix Figure S1より計算)
⌘ サンプルサイズは充分か?
→ 691と計算されており、primary outcomeは 772例と症例数も充分(多過ぎ?)。
⌘ 結果は?
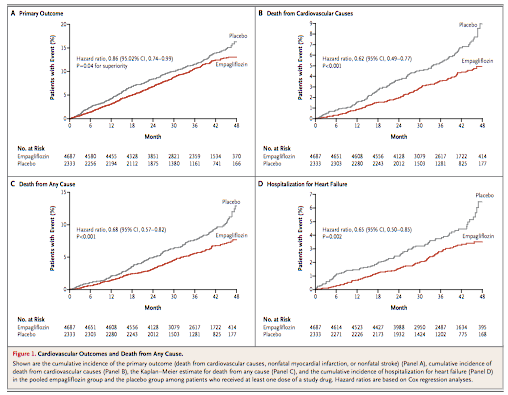
(Figure 1:本文より引用)
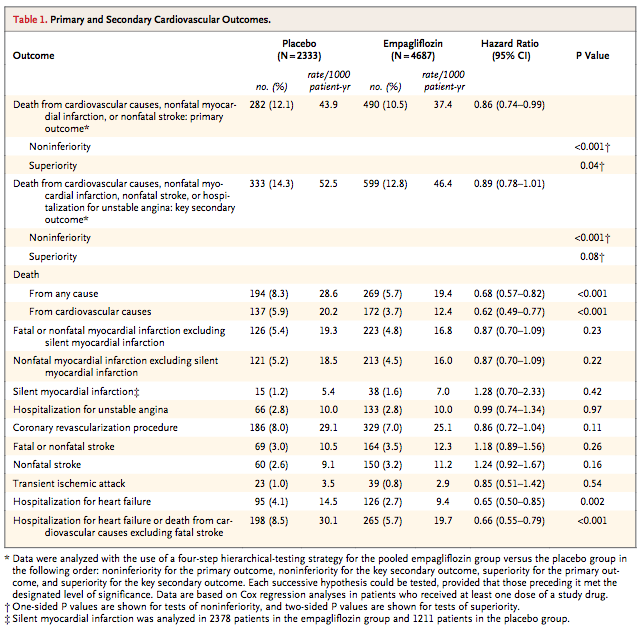
(Table 1:本文より引用)
→ Primary Endpoint(標準治療への追加効果)
エンパグリフロジン群(10 mg + 25 mgのプール):10.5%
プラセボ群 :12.1%
HR =0.86(95%CI =0.74〜0.99)
非劣性(両側;マージン1.3) :P <0.001
優越性(片側;マージン不明):P =0.04
RR =0.87
RRR =0.13(13%)
ARR =1.6%
NNT =63人
→ Key Secondary Endpoint
エンパグリフロジン群(10 mg + 25 mgのプール):12.8%
プラセボ群 :14.3%
HR =0.89(95%CI =0.78〜1.01)
非劣性(両側;マージン1.3) :P <0.001
優越性(片側;マージン不明):P =0.08 有意差無し
--- その他のアウトカム ---
→全死亡
エンパグリフロジン群(10 mg + 25 mgのプール):5.7%
プラセボ群 :8.3%
HR =0.68(95%CI =0.57〜0.82) P <0.001
→心血管死
エンパグリフロジン群(10 mg + 25 mgのプール):3.7%
プラセボ群 :5.9%
HR =0.62(95%CI =0.49〜0.77) P <0.001
エンパグリフロジン群(10 mg + 25 mgのプール):4.8%
プラセボ群 :5.4%
HR =0.87(95%CI =0.70〜1.09) P =0.23
→無症候性心筋梗塞
エンパグリフロジン群(10 mg + 25 mgのプール):4.5%
プラセボ群 :5.2%
HR =1.28(95%CI =0.70〜2.33) P =0.42
→不安定狭心症による入院
エンパグリフロジン群(10 mg + 25 mgのプール):2.8%
プラセボ群 :2.8%
HR =0.99(95%CI =0.74〜1.34) P =0.97
→冠動脈血管再建術
エンパグリフロジン群(10 mg + 25 mgのプール):7.0%
プラセボ群 :8.0%
HR =0.86(95%CI =0.72〜1.04) P =0.11
→致死性 or 非致死性脳卒中
エンパグリフロジン群(10 mg + 25 mgのプール):3.5%
プラセボ群 :3.0%
HR =1.18(95%CI =0.89〜1.56) P =0.26
→非致死性脳卒中
エンパグリフロジン群(10 mg + 25 mgのプール):3.2%
プラセボ群:2.6%
HR =1.24(95%CI =0.92〜1.67) P =0.16
→一過性脳虚血発作(TIA)
エンパグリフロジン群(10 mg + 25 mgのプール):0.8%
プラセボ群:1.0%
HR =0.85(95%CI =0.51〜1.42) P =0.54
→心不全による入院
エンパグリフロジン群(10 mg + 25 mgのプール):2.7%
プラセボ群 :4.1%
HR =0.65(95%CI =0.50〜0.85) P =0.002
エンパグリフロジン群(10 mg + 25 mgのプール):5.7%
プラセボ群:8.5%
HR =0.66(95%CI =0.55〜0.79) P <0.001
⌘ 考察
観察期間は約 3年であり、心血管イベントを抑制するには少し短いという印象。事実、DPP-4阻害薬であるシタグリプチン(商品名:ジャヌビア / グラクティブ)の大規模臨床試験TECOS(PMID:26052984)では、観察期間 3年(中央値)でプラセボ群に対して非劣性までしか示せていない(プラセボの非劣性って、もう経過観察で良くないですか?)。しかしエンパグリフロジンは、たった 3年?でプライマリーアウトカムに対し非劣性だけでなく優越性も示した(あくまで非劣性試験であり優越性については両側マージンを設定し、再度試験する必要があるがコストかかる。マージン1.0?も妥当と言って良いかどうか疑問)。DPP-4阻害薬の大規模臨床試験については患者背景が異なるという指摘もある。低血糖症状を引き起こさないようハイリスク患者は除外されているため効果を拾えていないという主張。この議論については次回以降ブログで取り上げたい。
メトホルミン(商品名:メトグルコ)以来の心血管イベント抑制は非常にインパクトがあり、臨床的にも有益な結果であると考えられる。しかし標準治療の上乗せ、add-onによる効果であることには留意する必要がある。つまり 2型糖尿病の治療戦略において、エンパグリフロジンが血管合併症予防のファーストラインにはならないということ。過度の飲酒や腎機能が過度に低下していない症例に対しては、まずメトホルミンを最大用量まで増量してから、エンパグリフロジン追加について患者と shared decision making しても良いのではないでしょうか(もちろん乳酸アシドーシスについては注意深く経過観察する)。
また SGLT2阻害薬カナグリフロジンの臨床試験 Canagliflozin Cardiovascular Assessment Study (CANVAS) trialの中間解析で "下肢切断リスク上昇の可能性" が示唆されており、FDAから安全性情報が発出されています(下記サイト内より抜粋)。従って 現時点で SGLT2阻害薬は、糖尿病治療のセカンドライン、サードラインにも成り得ないのではないかなと個人的には考えています(患者背景にもよりますが)。
心血管疾患の既往歴を有すハイリスク 2型糖尿病患者においては、血圧や脂質コントロールが心血管疾患の予防に重要ではないか、との意見もある(PMID:23992603)。血糖コントロールの指標である HbA1cについては、下げ過ぎはむしろ害となることが ACCORD試験(PMID:18539917)をはじめ相次いで報告されている。今一度「必要な患者に、必要な薬を、必要な用量、必要な期間」、使用するということに対して各々が考え、向き合う必要があるのではないでしょうか。
-------
⌘ 考察その 2
本試験あるいは他の報告で気になった点を以下に考察していこうと思う。
①ブラインドは破綻していた?
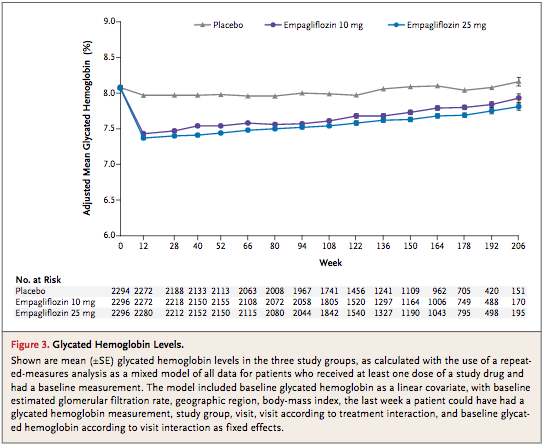
(Figure 3:本文より引用)
本試験は 42ヶ国、590施設で実施された。Figure 3の結果から投与 3ヶ月後にはエンパグリフロジン群で HbA1cが 0.7%程度低下している。プラセボ群が 0.1〜0.2%ぐらいの下がり幅であるため、一部の施設でブラインドは破綻していたのではないでしょうか。そうするとエンパグリフロジン群で心不全による入院が有意に低下しているのも納得がいく。ただブラインドであろうと無かろうと全死亡・心血管死というハードエンドポイントに有意な差があるため、本試験結果は妥当であると考えられる。ここで言いたいことは PROBE法でハードエンドポイントだけ見ればコストカットできたのではないかということ。
②心血管死の減少は心不全の抑制?それとも。。。
勉強会参加時にも話にあがりましたが、はたしてエンパグリフロジンの全死亡リスク低下はどのようにもたらされているのでしょうか? 2016年に発表された "サブグループ解析" 論文(PMID;26819227)において、ベースライン時の心不全の有無とは関係なくエンパグリフロジンが心血管死および心不全による入院を減少させた可能性が示唆されています。サブグループ解析であるため、あくまで "仮説生成" ですがエンパグリフロジンの心血管イベント抑制効果は心不全の増悪抑制ではない可能性が考えられます。これはメイン論文の Table S5をみても分かります(以下参照)。モヤモヤする。
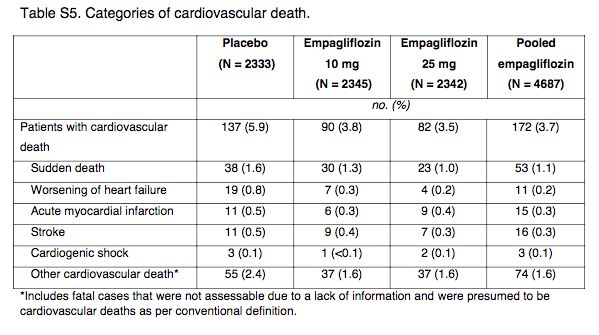
(Table S5:Supplementary Appendix より引用)
各エンドポイントの絶対差
→ 突然死 =0.4%
→ 心不全の増悪 =0.6%
→ 急性心筋梗塞 =0.2%
→ 脳卒中 =0.2%
→ 心原性ショック =0.0%
→ 他の心血管死 =0.8%(イベント数でみるとこれが多い)
③作用機序の一部は利尿薬と同じ?
面白いアプローチでエンパグリフロジンの心血管イベント抑制効果を説明しようとしている研究者もいます。本論文(PMID:27291329)では、エンパグリフロジンの心血管への有益な効果は尿中への糖排出ではなく、これに伴う利尿作用によるものではないかという仮説に基づき文献検索を行ったナラティブレビュー。結果はよく分からんとのこと。新しい知見を待っているようです。
④10 mgと 25 mgをプールして解析したのはなぜか?
不明だが、デザイン論文にも 2群プールして解析する旨が記載されているため、キーオープンしてから解析方法を変えたわけではない。
メリットとしては、試験実施側が informed consentを患者から取りやすくなる、患者側は1/2(50%)よりも 2/3(66.7%)、つまり絶対差で 16.7%試験薬に割り付けられる可能性が増えるため、ある種 Win-Win の関係と言えるだろう。
(閑話休題:個人的には臨床試験を人体実験と捉えているため、"新しかろう良かろう" という風潮には違和感を覚える。薬はベネフィットだけではなく必ずリスクが伴うことも伝えていきたい。しかし、そんなこと言ってたら新薬開発は進まない。新薬により恩恵を受ける患者がいることも重々理解しているつもりである。例えば近年、急速に市場を拡大しているC型肝炎治療薬は、間違えなくリスクよりベネフィットが優っている。C型肝炎から肝硬変、肝がんへの移行、これに伴う治療費、治療期間を考慮しても、やはり使う方が良いという結論に達した)
プラセボ群、試験薬群を 1: 2で割り付けるデザインの亜型?と捉えても良いかもしれない。従って、10 mg群、25 mg群で各々、プラセボと比べ有意差が出なかったのも納得できる。単純にサンプル数が足りないのだ。
ただし、プライマリーエンドポイントのイベント数が多過ぎる点は気にかかる。実際は 772例と、サンプルサイズ 691例よりもかなり多い。プライマリーエンドポイントの 95%信頼区間は 0.74〜0.99であり、症例数が少なくなったとしても非劣性マージン 1.3をまたがなかったかもしれない。しかし優越性は認められなかったかもしれない。←またまた勘違い。非劣性試験なので症例数は多い方が良く、少なければ少ない程、非劣性を達成しやすい。脱落が多い場合も非劣性を証明しやすいため、この場合は ITT解析と Per Protocol 解析との比較が重要となる。つまり本試験の症例数は充分である。しかし優越性についてはどうだろうか?(2015.5.16追記)
モヤモヤしつつ以上としたい。